
受験生の皆さん、こんにちは。
東大合格ビジネスマンのワタシですm(__)m
私のブログでは
① 入試問題の解答・解説
② 受験合格に必要なマインド
③ 3大基礎力重視の裏ワザ勉強法
について、様々な観点から発信活動を行なっております。
また、私の公式ラインでは無料相談を随時受け付けております。
公立中学出身から東大理Ⅲ,京大医学部のA判定に辿り着いた私が、大手予備校や受験秀才が言わない情報を存分に発信します。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、いち受験のプロの私に相談してみてください✊
私も、できない科目は先生を頼りました。
また、LINE登録していただいた方には
無料プレゼント(1年で偏差値70出す画期的勉強法)
を贈呈します🎁
【⬇️公式LINE登録はこちら⬇️】

2022年大学入試、旧帝大の第1弾は「北海道大学」です。
当ブログの解説記事は、読者の成績を最難関レベルまでグングン伸ばすことを目標にしており
読者が必死に3年間努力すれば東大(理三以外)・京大(医以外)・九大医レベルに80%以上の確率で合格できることを目的に作成しています✊
市販の問題集のように、解法を丁寧に示すだけではありません!
多角的なアプローチで問題を解きほぐしています。
① 各問の難易度
② 他分野や一般常識との関連事項
③ 問題の躓きポイント
④ 極力曖昧な表現をしない説明
を示しています。
イマイチ成績が突き抜けられない受験生に貴重な情報が提供できればと思いますm(__)m
北大化学の特徴
北大の理科は2科目150分。東大含めほとんどの旧帝大と一緒ですね。
数年前までは120分だったのですが、150分になっても全然重みを感じませんが・・・北大は何がしたかったのか🤥❓150→180分になって難易度も記述量も増して逆に重くなった京大とはえらい違いですなあ🤷♂️
化学は物理よりは難易度・分量とも重めな印象ですね(去年も)。なので、問題を深く理解するには、全統記述模試で偏差値55~60程度は必要でしょう🤔
第1問(Ⅰ)



【解答】
(問1)
(1) 易
(ア) L
(イ) 6
(ウ) M
(エ) +6
<分析>
電子殻は内側からK,L,M,N,O,・・となり、入る電子数は2n²(個)になります。これは覚えておきましょう☝
また、H₂SO₄のSの酸化数の求め方は、電気陰性度最大のOの酸化数を-2,電気陰性度最小のHの酸化数を+1とし、合計酸化数が0であることに着目すると、Sの酸化数が+6とわかります💡
(2) 易
あ,お
<分析>
H₂Oと(あ)~(お)の分子はすべて超有名なものなので、全部電子式を書いてしまった方が話が早いです💡

(3) やや難
(A)
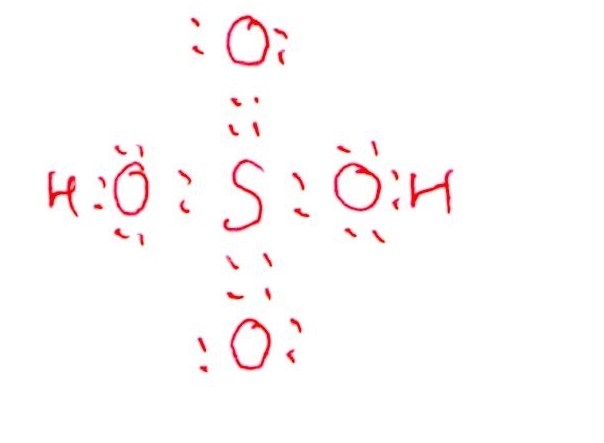
(B)
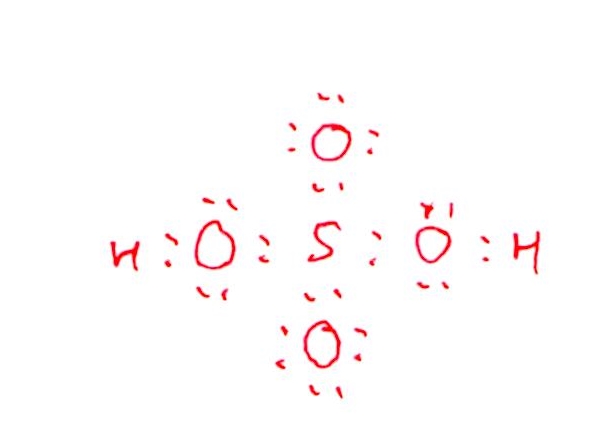
<分析>
硫酸はいわゆるオキソ酸です(H₂SO₄=S+H₂+(OH)₂)。なので、Sの周りには=Oが2つと-OHが2つ結合することがわかり、(B)の電子式は書けるでしょう。
問題は(A)ですね・・・原子価2て何!?ここで躓いた受験生が多かったでしょう。原子価というのは単結合1本で1、二重結合1本で2みたいな数え方をします👇

(4) やや易
け
<分析>
中心原子Sの周りの電子対4個はすべてCと共有されています。このことから、4個のCは正四面体の頂点に分布することが推察されます。メタン(CH₄)と同じ考え方ですね🤔
(問2)
(1) 易
ファンデルワールス
<分析>
「分子量が大きくなるほど大きくなる」がヒントです☝
(2) 標準
14族⇒ CH₄
15族⇒ PH₃
16族⇒ H₂S
<分析>
第4周期以降はわからん受験生が圧倒的に多いでしょう💦でも、ご心配なく✋
求めるのは沸点が最小の分子です。ということは、分子間水素結合をしなければ分子量が小さいものが答えなわけです。ここで、第2,3周期の14~16族の原子(C,N,O,Si,P,S)のうち水素結合するのはH₂OとNH₃です。したがって、答はそれぞれ上記のようになります。
本問はノーヒントで水素結合を意識しないといけない点がやや難易度を上げてます🤔
(3) やや易~標準
2.4 (kJ)

<分析>
氷の結晶構造の知識が必要な分、難易度が高いです。「水分子1個あたり水素結合が2個」という知識は難関大では頻出なので、これを機に覚えておくとよいと思います🤔
# 氷の結晶(イメージ)

<感想>
原子・分子の性質を多角的に問う問題でした。内容的には決して難しくないのですが、地味に頭を悩ます箇所がありました💦
(問2)では「水素結合の有無」を自分で判断することが必要でした。いつもの「NH₃とH₂Oの沸点が高い理由を述べよ」とは違う聞かれ方してました💦
あとは、(問3)の原子価と(問5)の水素結合の数で地味に得点差がついた気がします🤔
第1問(Ⅱ)



【解答】
(問1) やや易
(1) ヘンリー
(2)

(a)

(b)
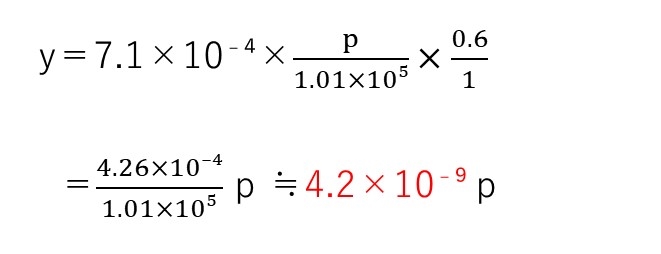
(c)
4.1×10⁻⁸p+0.42×10⁻⁸p=0.013 ⇒ p=2.9×10⁵(Pa)
(3) し,そ
<分析>
駿台全国模試なんかで頻出のパターンです。「状態方程式から気体分を求める」⇒「ヘンリーの法則から溶解分を求める」⇒「初期条件に当てはめる」のパターン。
紫蘇🍀(笑)ヘンリーの法則は水に溶けにくい気体で成立するので、電解質のHClと可溶性のNH₃はアウトです🙅
(問2) やや易
C
<分析>
完全電離後のモル濃度を算出すると、NaClは4.0×10⁻³(mol/L)、CaCl₂は6.0×10⁻³(mol/L)、KClは8.0×10⁻³(mol/L)、スクロースは1.0×10⁻³(mol/L)、グルコースは2.0×10⁻³(mol/L)。ここで、「Aの液面がBの液面より高くなる⇒Aに水が流入する」より、Bのモル濃度はAより小さくなる必要があり、液面差が最大となるには濃度差が大きくなる必要があるので、答は(C)。
(問3) 標準
た,つ,と
<分析>
紫蘇の次は達人❓北大さん、ネタ仕込みすぎでしょww
ちなみに、各選択肢の検討は以下の通りです👇
(た) ×
蒸気圧降下が起きた結果、沸点が上昇するので×。
(ち) ○
正しい。
(つ) ×
凝固開始後は水から先に凝固するため、溶液は段々濃くなっていきます。よって、質量モル濃度の増加に応じて温度も徐々に低下していきます。これは記述問題で出されても書けるようにしたいですね✊
(て) ○
正しい。NaClの例で言うと、Na⁺はO²⁻とCl⁻はH⁺と引き合います。
(と) ×
塩析は「多量」の電解質を加えて沈殿させるときの話。
(な) ○
「見かけ上何も起きていないように見える」現象のこと。気体の平衡と同じこと言ってますね🤔
<感想>
(問1)はヘンリーの法則に関する典型問題で、解法も王道パターン👑
(問2)は、電解質と非電解質で勝手が違ってくること、浸透圧の何たるかを理解していれば余裕です!
(問3)は一問多答型の問題で、必然的に難度は増します。今回は判断に苦しむ選択肢はなかった印象ですが、この手の問題に強くなるには、各選択肢○×の理由を自分なりに根拠を付けて説明する習慣をつけましょう✊
第2問(Ⅰ)


【解答】
(問1) やや易
(ア) え
(イ) き
(ウ) ステンレス
(エ) テルミット
<分析>
完全なる暗記問題。きちんと覚えましょう💡テルミット反応が盲点だったかもしれませんね。
・ステンレス鋼
食器や洗面台に使われます👇
・テルミット反応
(問2) 易~やや易
六方最密構造⇒2個
面心立方格子⇒4個
<分析>
単位格子の原子の数え方は大丈夫ですよね?
今回は問題文に指示がありましたが、ノーヒントだと六方最密構造の単位格子を間違える受験生は多発したでしょうね🤷♂️今後のためにも、注意して覚えておきましょう。
(問3) やや易
(オ) 0.21(nm)
(カ) 0.18(nm)
<分析>
(オ)
最も近いO²⁻は単位格子の面中心にあるので、0.42(nm)の半分です。
(カ)
鉄イオンが格子の対角線上にあることに着目します。0.42√3×1/4=0.7266/4≒0.18(nm)
(問4) 易~やや易
(1)
(a) 3
(b) 2
(c) 3

(2)
Fe:70(kg)
CO₂:83(kg)
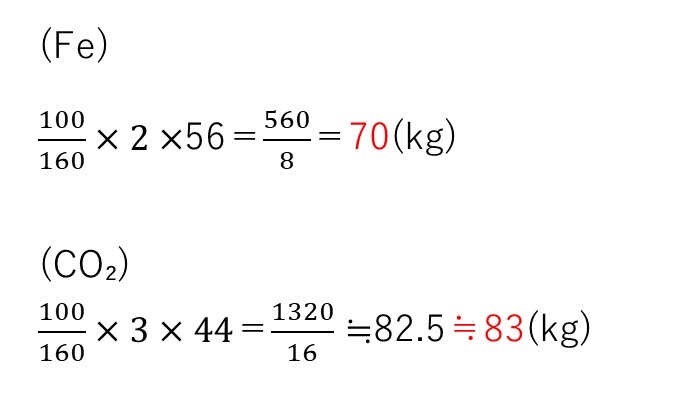
<分析>
(1)はFe,O,Cについて係数比較するだけです。(2)は(1)の結果と原子量を用いて求めればOK。
(問5) 易
2Al(固)+Fe₂O₃(固)=Al₂O₃(固)+2Fe(固)+852kJ

<分析>
ただの引き算です。全然難しくない。
<感想>
(問1)はFe関連の基礎知識。
(問2)~(問5)は酸化鉄を題材にしているだけで、実質、簡単な理論化学です。このパートは第1問よりは確実に楽ですね~🎵
第2問(Ⅱ)


【解答】
(問1) 易
45
<分析>
Br₂の分子量160より、Brの質量数は80。質量数=原子番号+中性子数より、求める個数は80−35=45。
(問2) 易~やや易
け
<分析>
2Cl⁻→Cl₂+2e⁻の反応が起きるのは陽極。陰極では水(H₂O)が2H₂O+2e⁻→H₂+2OH⁻の反応を起こしH₂を発生します。イメージは以下の通り。「陽イオン交換膜」はいつも「陽イオン交換膜だから」という適当な選んだ方が多いと思いますが・・・なんで陰イオン交換膜じゃダメなのかを考えてみましょう🤔
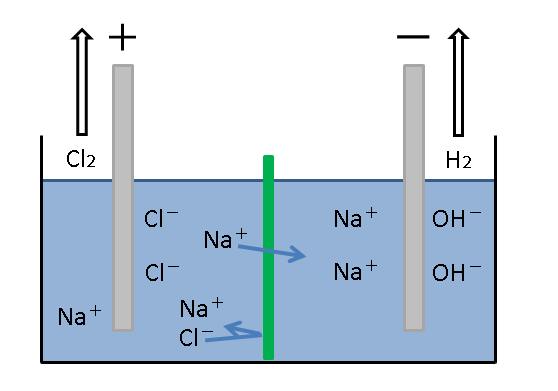
※ 陰イオン交換膜ではCl⁻とOH⁻が混在してしまい、純粋なNaOH水溶液が作れなくなるからです☝
(問3) 易~やや易
A:H₂
B:NaOH
<分析>
(2)でイメージがつかめていれば、余裕でしょう。
(問4) 易~やや易
Cl₂
<分析>
Brよりも電気陰性度が大きいハロゲンが適切ですね。Fでもいい気が💦
(問5) やや易
Cl₂O₇+H₂O → 2HClO₄
<分析>
七酸化二塩素が化学式で表せるかがすべてでした💦
(問6) 標準
H₃O⁺、ClO₄⁻
<分析>
HClO₄・H₂Oだと普通はH⁺が生じるように思えますが、H⁺は間違いです。なぜH₃O⁺なのかについては、(v)の後文がヒントです💡
(問7) やや易
IO₃⁻+6H⁺+6e⁻→I⁻+3H₂O
<分析>
Iの酸化数について、IO₃⁻では+5,I⁻では−1なので、酸化数変化は−6。よって、電子の係数は6と決まります!あとは、係数と電荷を帳尻合わせすることで答が出ます。
<感想>
前半は演習経験があれば簡単です。NaCl水溶液の電気分解は口頭で説明できるくらい理解しておきましょう!あとは、ハロゲンの酸化還元ですね。イメージとしては、「電気陰性度の大きいハロゲンの方が0→-1の変化を起こす」。
(問7)の半反応式は<分析>の方法で確実に作れます✊ただ、これでは有機化合物の構造式が出てきたときに悩みますよね・・・それは別途、有機化合物の酸化数の数え方というのがあるので、そこで学習しましょう!
第3問(Ⅰ)


【解答】
(問1) やや易~標準
(ア) 水酸化ナトリウム
(イ) 塩酸
<分析>
(ア)
反応液はHClの存在により酸性です。つまり、塩基のアニリンは酸性条件下では-NH₂ではなく-NH₃Clとして存在します☝よって、-NH₂にするために、強塩基を加える必要があるのです。なので、答は水酸化カリウム等でもOK。
(イ)
Aはアミド化合物ですね。では、加熱するのはなぜか?加水分解させたいからです💡よって、加水分解してさらに-NH₃Clにしたいとなれば、加えるべきは酸です。ただし、酢酸や炭酸では加水分解が起きない(だろう)から、答えるのは「塩酸」が無難でしょう💦
(問2) やや易
0.86 (ml)
<分析>
答えるのは体積ですが、異なる物質の収支関係は物質量で扱うのが受験化学の鉄則です✊
ベンゼンの体積をx(ml)とすると、ベンゼンとニトロベンゼンの分子量が各々78,123より、0.88x/78=1.2/123 ⇒ x≒0.86。
(問3) 易~やや易
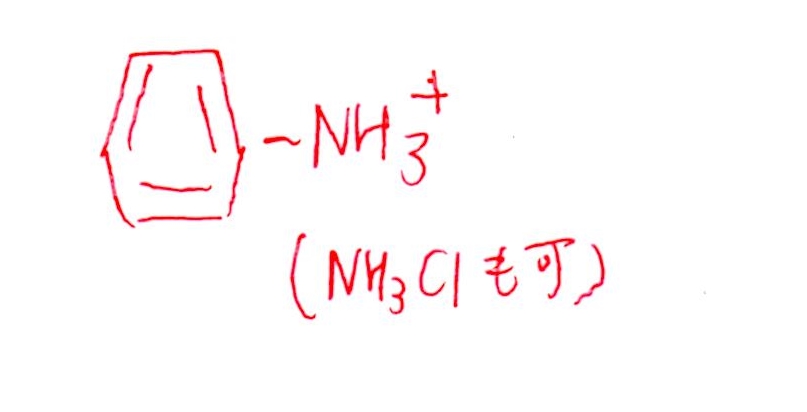
(問4) 易~やや易
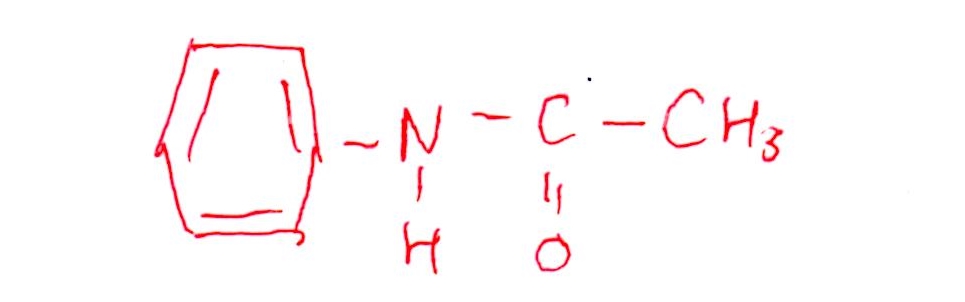
<分析>
問3,4の2つは問1がきちんと答えられれば自動的にできますし、何なら(問1)と無関係にできます(笑)
(問5) やや易
え
<分析>
さらし粉(CaCl(ClO))はアニリンの呈色反応として有名ですね!このとき、アニリンはClO⁻により酸化されて赤紫色になります。ClO⁻は酸化剤として有名ですよね💡
また、アニリンブラックは受験では影薄いんですが、一応確認はしておきましょう👇

(問6) やや難
(ウ) パラ
(エ) オルト
(オ) 3
(カ) 水酸化ナトリウム
(キ) ヒドロキシ基
<分析>
これはむずいですね・・・-OHが電子供与性ってのを自己判断する部分もむずいけど、これはまだ経験的にオルト・パラだと判断できるはず✊
では、一番むずいのは何かっていうと、あまり有名でないアセトアミノフェンから(ウ)のパラ/オルトの判断をしなきゃいけないとこ💦💦
アセトアミノフェンって今の受験化学的には常識なんでしょうか??普通、有名所としてもってくるのサリチル酸誘導体でしょ😭❓

<感想>
(問2)~(問5)は比較的簡単ですが、(問1)は液性をスルーしがちな受験生は混乱したかも🤔💦電気分解、半反応式でもそうですが、普段から液性を意識しておきましょう✊
(問6)は全くわからないではないけど、(ウ)がパラだと確信をもって判別するのがむすいですね💦(問6)の穴埋めは半分落とすのもやむをえないか?
第3問(Ⅱ)

【解答】
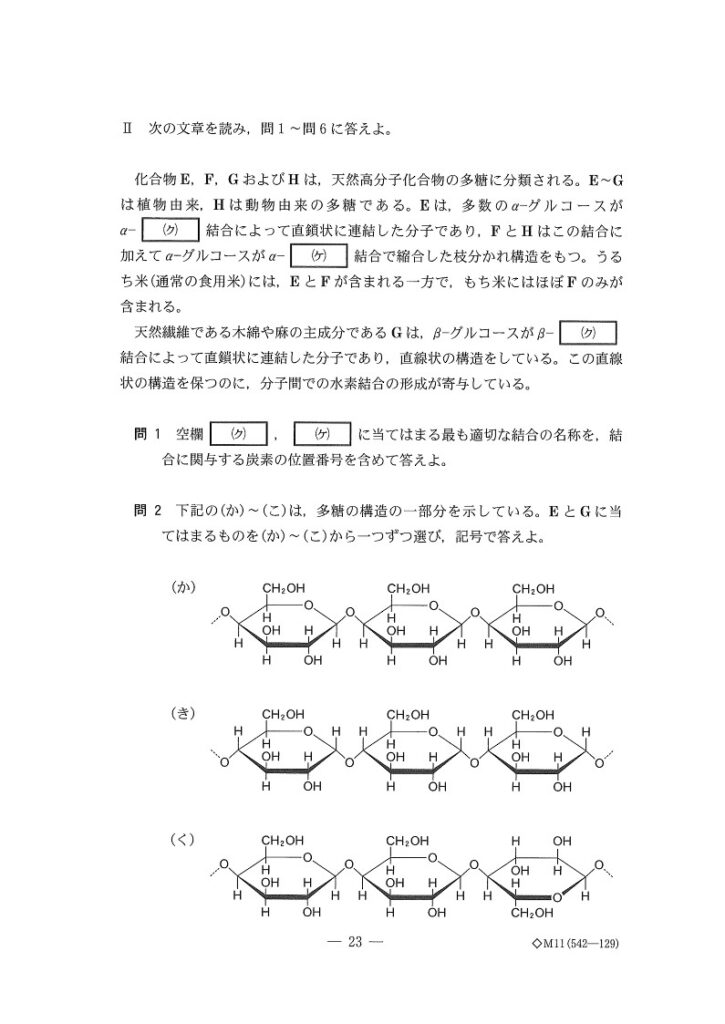
<化合物E~Hの特定>
デンプン(α-グルコースから成る多糖)にはアミロースとアミロペクチンが存在します。また、β-グルコースから成る多糖はセルロースで植物にしか存在しません。細胞壁の構成成分です。FとHの判別ですが、Hが動物由来である点から、Hは肝臓でエネルギー源として貯蔵されるグリコーゲンだと考えられます🤔
E→ アミロース
F→ アミロペクチン
G→ セルロース
H→ グリコーゲン
(問1) 易~やや易
(ク) 1,4 グリコシド
(ケ) 1,6 グリコシド
<分析>
これは暗記ですね💦
「なんで1,5グリコシド結合はないねん!?」と聞かれても、私もわからないし、そもそも出てこないし、大学受験レベルで論理的に説明できる人はいないでしょうから…覚えるが勝ちですね😂
(問2) やや易
(E) き
(G) こ
<分析>
「α型,β型でどう違うか」「1位,4位のC原子はどこか」さえ理解していれば、余裕でできます。β型で糖が反転している点、注意しましょう!
(問3) 易
5
<分析>
4つの置換基がすべて異なる場合に不斉炭素原子となります。グルコースでは6位のみが不斉炭素から外れます。
しかし、登場するのがほとんど直鎖型(不斉炭素原子4)というのもあり、早とちりで4と誤答した受験生もいたかな??
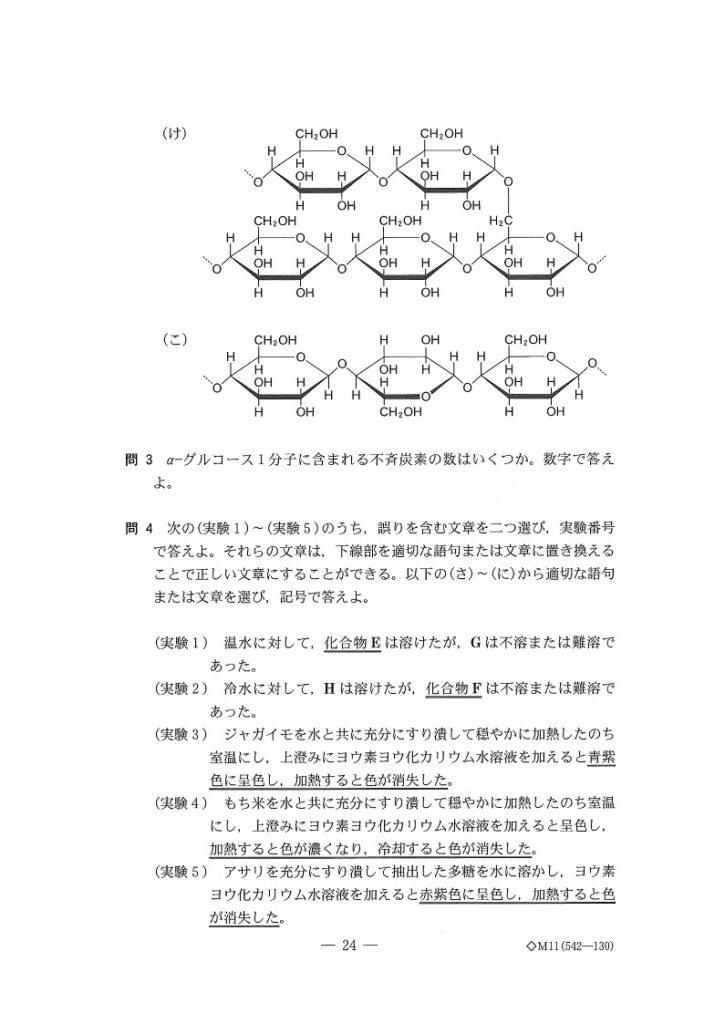
(問4) 標準~やや難
4,(に)
5,(そ)
<分析>
(実験3)の内容を確認してみましょう。これはいわゆる「ヨウ素デンプン反応」というやつですね👇呈色の機序については、記述問題でも書けるようにしておきましょう✊

加熱すると、「デンプンのらせん構造が解ける ⇒ I₂が飛び出す ⇒ 無色化」の変化を起こすようです🤔となると、(実験4)は(実験3)と逆のこと言ってるから×ですね。
(実験5)のアサリの多糖て何?知らんわ!とはいえ、消去法でも選べるっちゃ選べます💦とりあえずデンプンじゃないんだろうから、「青紫色」じゃなくて「赤褐色」なんだろうな~て感じで(笑)
(問5) 標準
は
<分析>
アミロペクチンに希硫酸加えて加熱ですか・・・加水分解してα-グルコースにしたいんでしょうね🤔そして、答の選択肢を見ると見覚えのある試薬が3種類ほどあります。
答からの逆算になりますが、酢酸鉛(Ⅱ)と塩化鉄(Ⅲ)はないね。だって、S(硫黄)とかフェノールを匂わせる記述が皆無なんで👋あとは、単糖とCuSO₄から考えると、この反応はフェーリング反応だと言いたいんでしょう🤔💡
確認ですが、グルコースは水溶液中で以下の平衡を保っています!
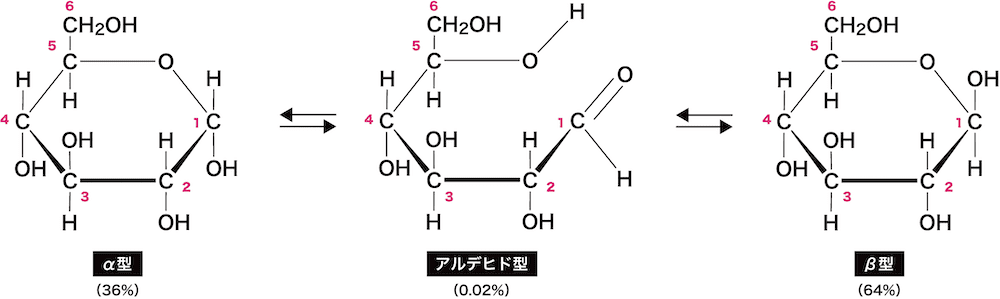
「アルデヒドめっちゃ少ないのに何で呈色するん?」と思った方多いでしょう💦
しかし、その謎はルシャトリエの原理で解けます。
アルデヒドがフェーリング反応を受けるとカルボン酸となり、上記の反応系から抜けます。すると、アルデヒドが減少した分、α型,β型から移動してきます。これが順々に起きて、十分時間がたつとほぼ全量の単糖が反応するというカラクリです🤣
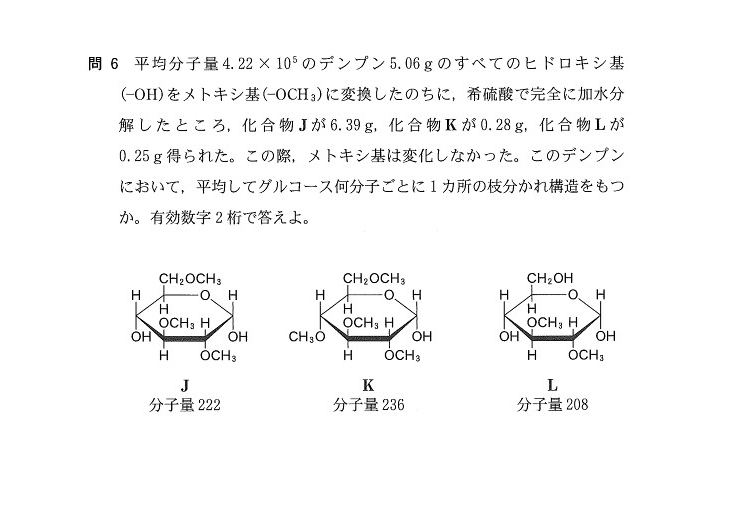
(問6) やや難
26
<分析>
枝分かれの個数(割合)を決めるのは化合物Lです。またJは途中にある糖、Kは左末端の糖です。さらに、右末端のはない設定で考えてよさそうですね。
となると、デンプンの構造は以下の模式図で考えてよさそうです🤔

J⇒6.39/222 ≒ 2.88×10⁻²(mol)
K⇒0.28/236≒1.19×10⁻³(mol)
L⇒0.25/208≒1.20×10⁻³(mol)
よって、物質量比はJ:K:L=28.8:1.19:1.20≒24:1:1。模式図を見ると、1列にK,Lは1個,Jは24個存在すると考えられ、枝分かれは24+1+1=26分子ごとに1ヶ所あるといえます💡
<感想>
糖類に関する典型的問題で、程よく思考力を問う良問でした!特に、(問6)の枝分かれの数を求める系の問題は頻出かつ難関大では設定がややこしくなりがちなので、よく理解しておきましょう✊
ただ、アサリの多糖・・・何かわからんのは解せないね😮💨
総括
高得点の難しさは大問別に2>>1=3の印象。ただ、私的には1>3かな。
1は基礎を深く理解していると完答可能ですが、3はややマイナーな知識がないと完答無理っぽいので。
第2問で得点を稼いで、第1,3問では難しめのは落としていいけど大量失点は避けるという戦略がベストでしょう。
解説記事をもとに徹底的に理解すれば、受験直前には85~90%までは取れる力が身に付くと思います✊
合格点は
非医:55~60%
医:70~75%
程度でしょう。
では、以上で解説を終わります。
最後に、再度公式ラインの紹介をします。
私の公式LINEでは、無料相談を随時受け付けております。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、受験のプロを頼ってみてください✊
【⬇️公式LINE登録はこちら⬇️】







