
受験生の皆さん、こんにちは。
東大合格ビジネスマンのですm(__)m
私のブログでは
① 入試問題の解答・解説
② 受験合格に必要なマインド
③ 3大基礎力重視の裏ワザ勉強法
について、様々な観点から発信しております。
また、私の公式ラインでは無料相談を随時受け付けております。
公立中学出身から東大理Ⅲ,京大医学部のA判定に辿り着いた私が、大手予備校や受験秀才が言わない情報を存分に発信します。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、いち受験のプロの私に相談してみてください✊
私も、できない科目は先生を頼りました。
また、LINE登録していただいた方には
無料プレゼント(1年で偏差値70出す画期的勉強法)
を贈呈します🎁
【⬇️公式LINE登録はこちら⬇️】

今回は、2022年共通テスト化学の解説です。
私自身が現役プレイヤーなので、学校の先生や予備校講師といった指導者目線ではない、プレイヤー目線でまた違う徹底的に語りつくすことができるのでは?
と思い作成しましたm(__)m
思いの他得点できなかった受験生が多くいたようですが、私的には例年通りの難しさかな?と感じました。
とはいえ、細かい知識問題が所々難解で、90/100点以上の高得点は難しいという印象💦
では、早速問題を見ていきましょう👀
第1問





【解答】
(問1) 易
2
<分析>
電子殻が内側からK,L,M,N,・・と理解していれば、原子番号5の原子を答えればいいとわかりますね。よって、B(ホウ素)。
(問2) 易
2
<分析>
分子量に占めるNの割合が最大のものを答えればOKです。
①:14÷53.5=0.261・・
②:28÷60=0.461・・
③:28÷80=0.350
④:28÷132=0.212・・
(問3) やや易~標準
4
<分析>
少し難しい?
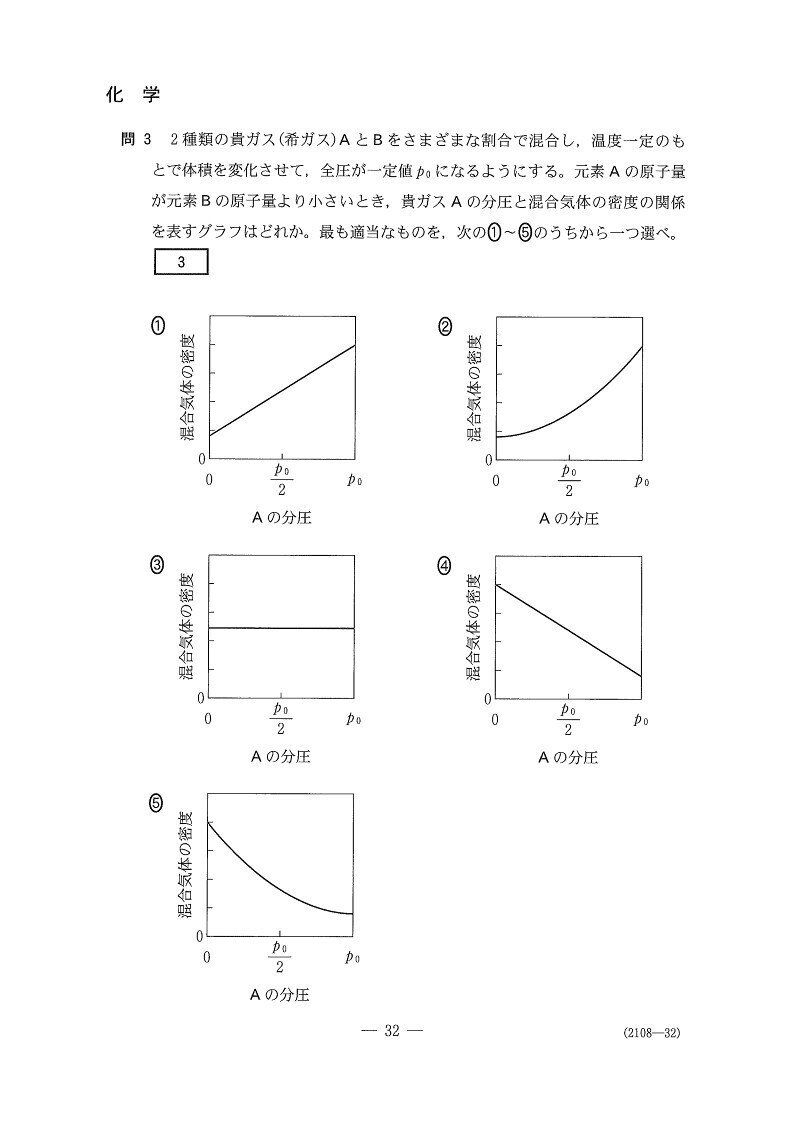
状態方程式と平均分子量から考えます。
混合気体の密度をρ、平均分子量をM₀とすると、状態方程式PV=nRTを変形することでPM₀=ρRTが得られ、ρはM₀に比例することがわかりますね💡
Aの分子量はBより小さいので、全部Aより全部Bの方が密度は高いということになります!
よって、正解は4。
(問4) やや易~標準
4
<分析>
アモルファス(非晶質)の問題が来ましたか🤥まず「非晶質」を知らないと解けませんね💦
非晶質は場所ごとで結合が不規則で、融点が一定でないことが特徴です!
(非晶質のイメージ)

また、SiO₂が光ファイバー(内視鏡等)に使用されることは常識として覚えておきましょう。
4は、むしろ規則正しく結合する結晶の特徴です。
(問5)
(a) 易~やや易
2
<分析>
1.0×10⁵(Pa)で、水1Lに溶けるO₂の物質量は、10℃→20℃で(1.75-1.40)×10⁻³=0.35×10⁻³(mol)減少するので、
水20Lあたりで考えると、0.35×10⁻³×20=7.0×10⁻³(mol)減少します。
(b) 標準~やや難
3
<分析>
共テにしてはやや難しい問題です。まず脱離したN₂の物質量を求め、次いで状態方程式を用いて体積を求めます💡
なお、条件より、N₂:O₂=4:1は常に保たれます!

第2問


【解答】
(問1) やや難
3
<分析>
これ知識問題だけど、むずくない??自信もって切れたの4だけ💦💦
私は知らなかったけど・・・「NaClの電離は吸熱反応」って今時の受験生的には常識なの??
1→「燃焼熱」というやつ。発熱反応なんかな~?
2→「中和熱」というやつでしょうか。これも発熱反応ぽいですね~🤥
4→液体から固体になる際は熱が放出されます(吸熱)。
(問2) やや易~標準
3
<分析>
弱酸の電離に関する問題。まず、CH₃COONa+HCl→CH₃COOH+NaClの反応によって、酢酸が3.0×10⁻²(mol/L)生じるのはOKですか?
弱酸の電離を考える際、酸の濃度をC,電離定数をKとすると、α=√K/C<0.05なら[H⁺]=√CKで近似できるのですが、そうでない場合は2次方程式を解くことになります🙄
本問ではα=0.03<0.05なので、近似式が使えます。弱酸だし何となく[H⁺]=√CKだろ~と機械的に解いても今回は当たりますが、α>0.05のときは間違えるので、ちゃんと検証してください✊
(問3) やや易
1
<分析>
まず、初期量と反応式より常に[B]=[C]であることを見抜きましょう。
平衡時に[B]=[C]=x(mol/L)(0<x<1)とすると、[A]=1-x(mol/L)であり、正反応と逆反応の速さが等しいから、k₁[A]=k₂[B][C]が成り立ちます。
よって、6x²+x-1=0 → (2x+1)(3x-1)=0 → 0<x<1よりx=1/3。
(問4)
(a) やや易
4
<分析>
X248(g)の体積は、248÷6.2=40(cm³)=40(ml)で、吸蔵できるH₂の体積は40×10⁻³×1200=48(L)。
標準状態(=22.4L/mol)で考えると、求めるH₂の物質量は48÷22.4=2.14・・≒2.1(L)。
(b) 標準
4
<分析>
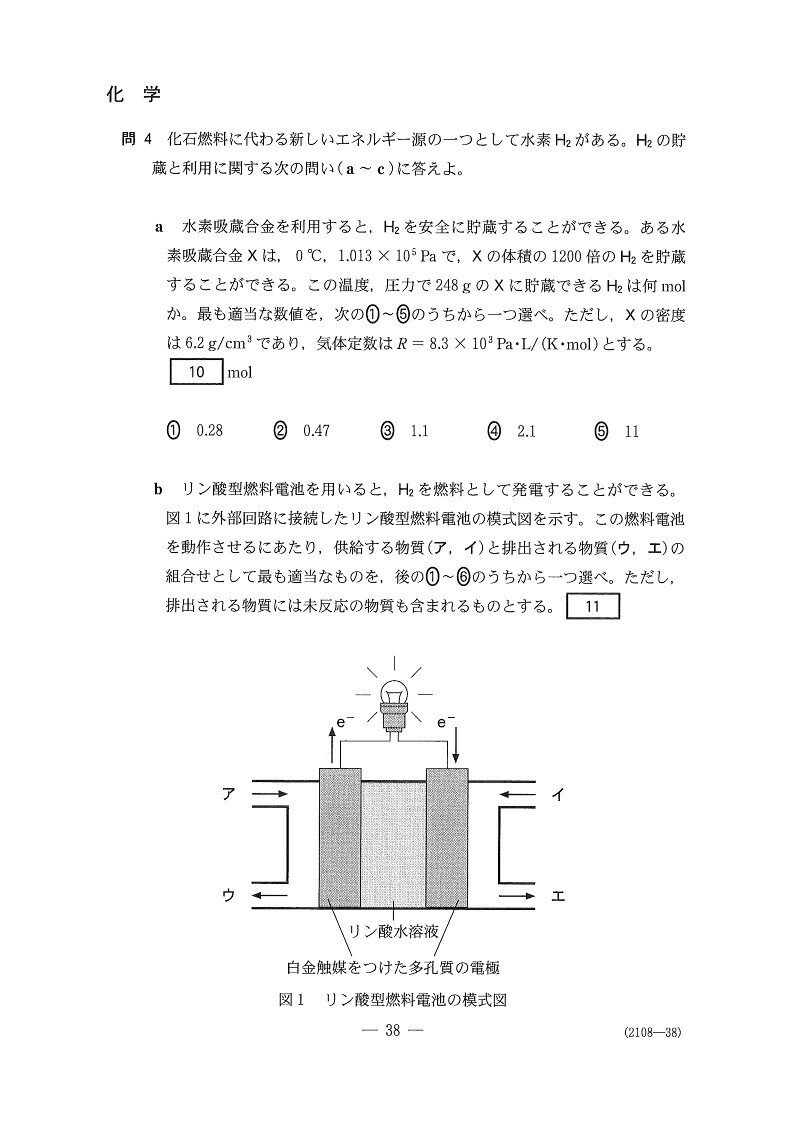
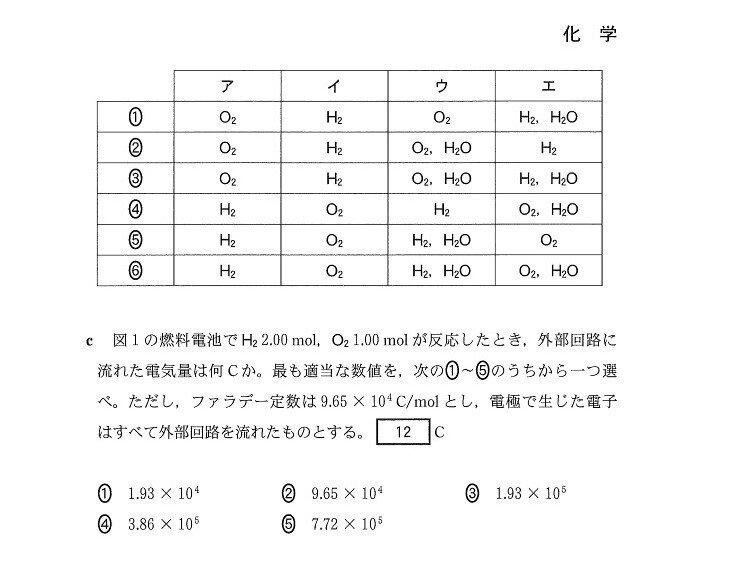
まず、電子の流れから「左側が負極、右側が正極」と判断しましょう。
あとは、O₂,H₂それぞれがH₂Oに変化する際に、O₂は還元されH₂は酸化されることに着目すると、O₂+4H⁺+4e⁻→2H₂O、H₂→2H⁺+2e⁻の半反応式が立ちます。
H₂は回路に電子を供給することを考えると、答は4となります。
(c) 標準
4
<分析>
(b)の半反応式より、O₂1molあたり4molの、H₂1molあたり2molの電子が流れます。
∴9.65×10⁴×4.0=3.86×10⁵(C)。
第3問


【解答】
(問1) 標準~やや難
3
<分析>
AlK(SO₄)₂・12H₂Oは弱酸性のミョウバンです。と言っても、弱酸性とその理由を知らん受験生が大半でしょう。
詳細は「医学部の化学(慶応医の問題)」にあるので、持参している人は一度目を通してみましょう👀
1→アンモニア水が溶けてNH₄⁺が生じ、NH₄⁺+Cl⁻→NH₄Clの反応により白煙を生じる。
2→ミョウバンの方はCaSO₄の白色沈殿を生じます。
4→ミョウバンとNaClで発生する気体が異なるので判別可能!
う~ん、「ミョウバンは弱酸性」を知らなくても、一応消去法でいけるかな😅
(問2) やや易
1
<分析>
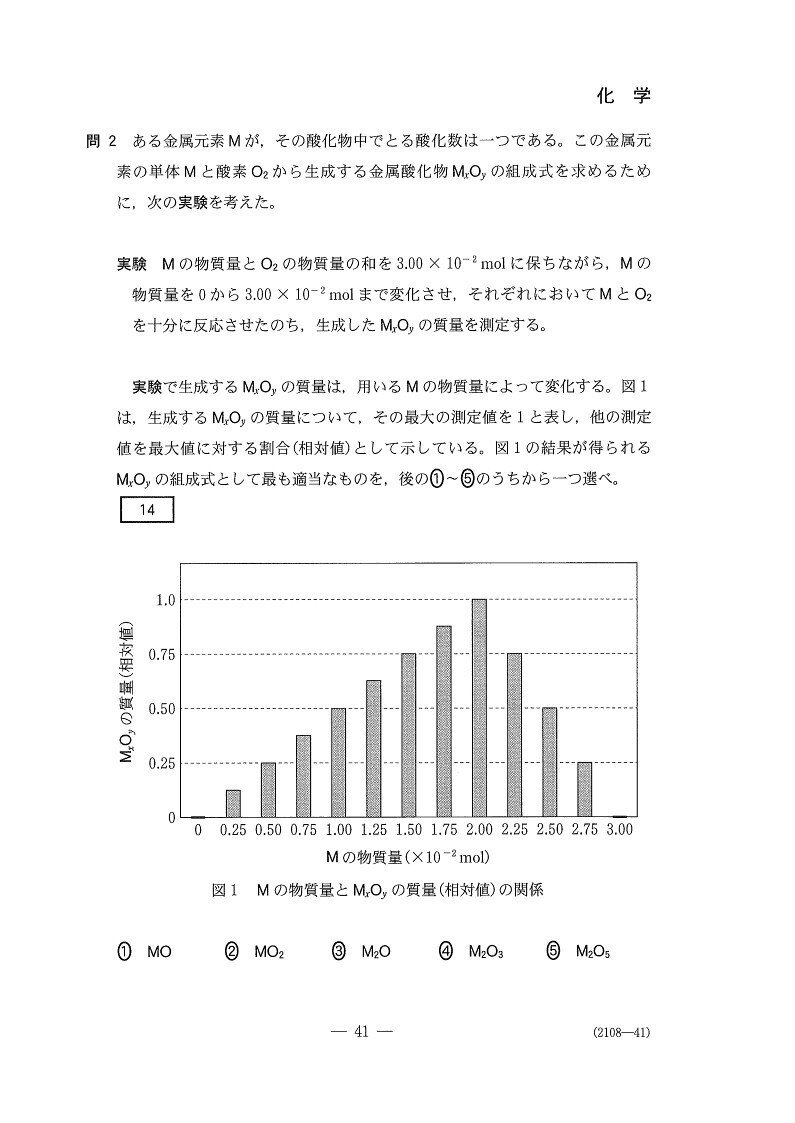
グラフを見ると、Mの物質量が2.0×10⁻²(mol)でO₂の物質量が1.0×10⁻²(mol)のときに酸化物の質量(物質量)が最大となっています☝
つまり、xM+y/2 O₂→MxOyの反応において、x:y/2=2:1→x:y=1:1のときに両者は過不足なく反応する訳です。
(問3)
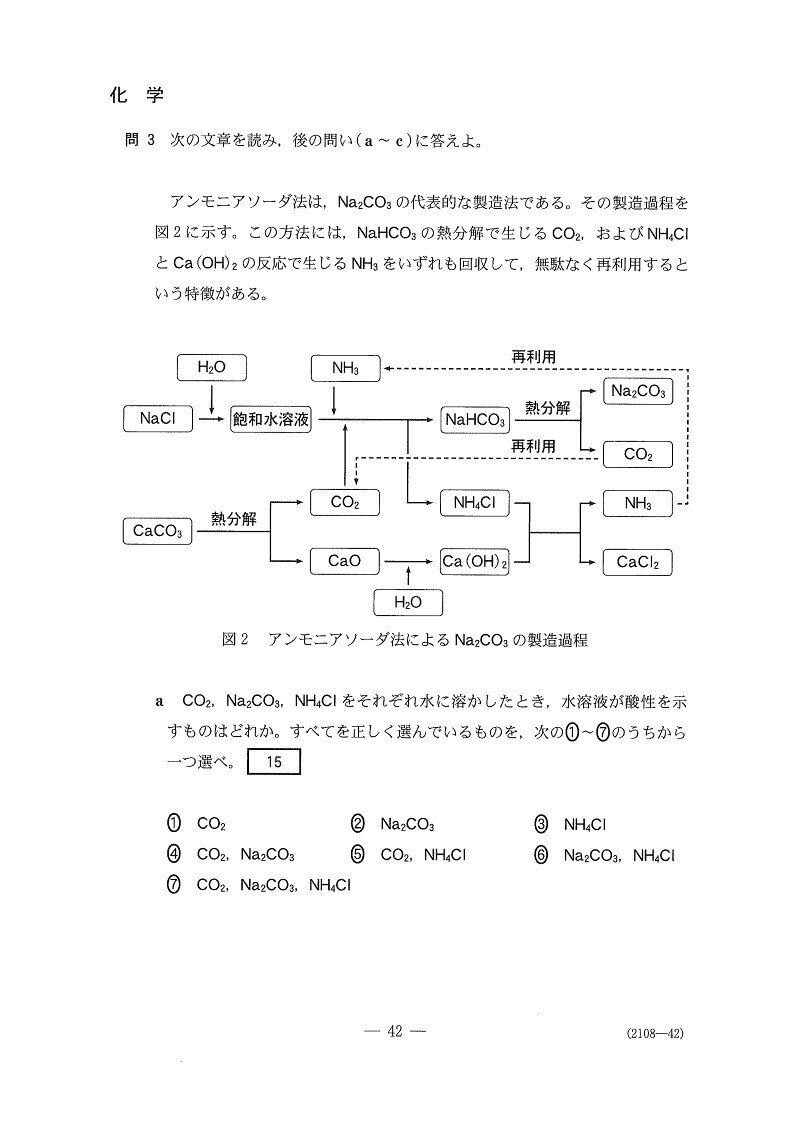
有名なアンモニアソーダ法の登場です👀
(a) やや易
5
<分析>
CO₂は弱酸、Na₂CO₃は弱塩基、NH₄Clは弱酸ですが・・・これは理解できますか??
NH₄Clは弱塩基NH₃と強酸HClからなる塩なので弱酸ですよ〜。
(b) やや難
1
<分析>
共通テスト化学の満点キラーは大概この手の正誤問題なんですよね。本問もなかなか手強い。
1,3の判別が難しいですね。NaHCO₃は確かに溶解度小さそうだけど…
3は触媒はどの反応も不要か?と聞かれると確信は持ちにくいでしょう💦
私も、硫酸を製造する接触法では触媒を用いるけど、アンモニアソーダ法はなかったかも?くらいの認識でした。
(2,4について)
2は有名。記述問題でも書けるようにしておきましょう☝
4の反応式では以下のようにH₂Oも発生します。2NaHCO₃→Na₂CO₃+CO₂+H₂O。
(c) やや易
2
<分析>
反応物がNaCl,CaCO₃で生成物がNa₂CO3とCaCl₂だと考えると、次の化学反応式が立ちます。
2NaCl+CaCO₃→ CaCl2+Na₂CO₃。
よって、58.5/58.5 × 1/2 × 100 = 50.0(kg)。
第4問


【解答】
(問1) 易〜やや易
4
<分析>
1〜3がよくわかりませんね~😵
でも、プロピンの構造式がわかり、炭素の番号の付け方がわかれば、明らかに4が間違いなのがわかります。
1→ 通常の炭化水素では光の作用で置換反応が起きるのに対して、ベンゼン環ではかむしろ付加反応が起こります。
3→ ブタジエンにも見られる共役二重結合ですね。
(問2) 易〜やや易
2、2
<分析>
-OH基からみて-NO₂基はオルト位、パラ位にしか入りません✋
そこに着目すれば、1置換体,2置換体とも2種類しかないとわかります。
(問3) やや易
5
<分析>
これも問1と同様、1〜4の正誤がわからなくても、PETの構造を知っていれば一発で解決します☝️
PETの原料はテレフタル酸とエチレングリコールでしたね👏
2→酵素の変性の原理もこれです。記述問題でも書けるようにしておきましょう☝️
4→これは乾性油でも見られる特徴でしたね!C=Cは空気酸化を受けやすいのです。
1,3→ ややマイナーな知識かな💦
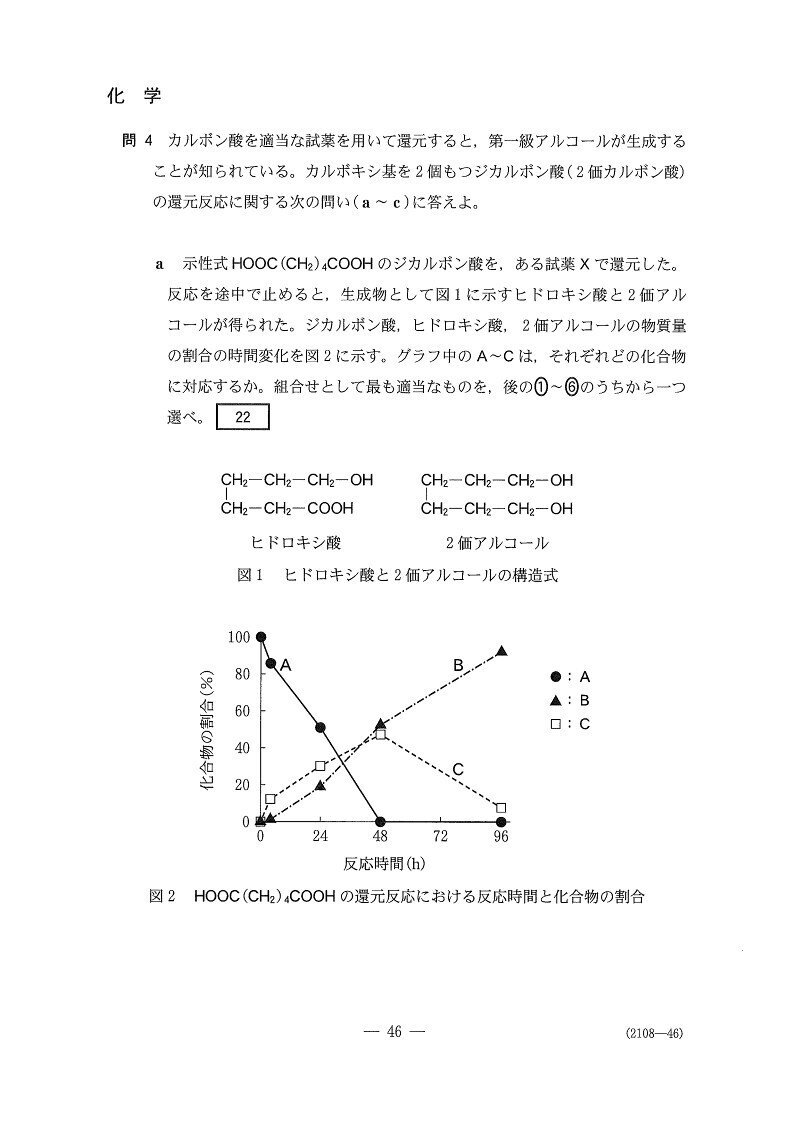
(問4)
(a) 易
2
<分析>
「最初大量にあって最後に大量にあるのは何か?」を考えると非常に簡単。
ヒドロキシ酸は還元過程で生じる中間体なので、最初と最終で0になるグラフを描きます📈
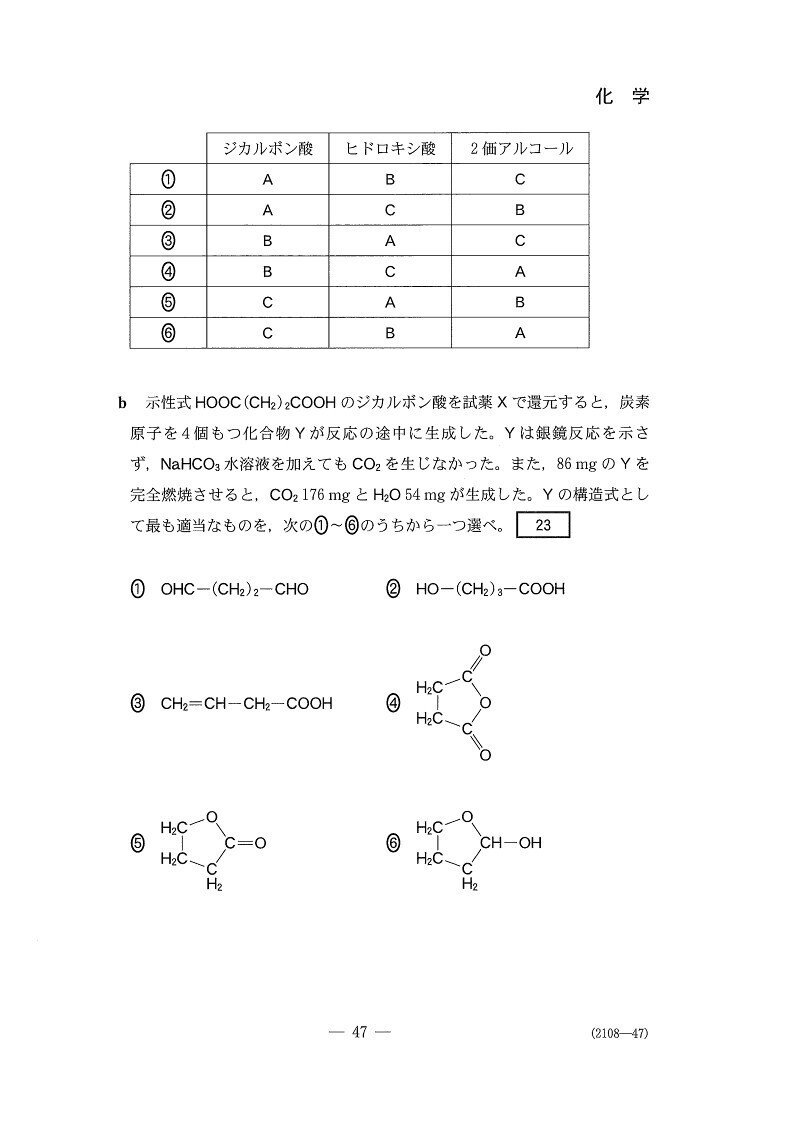
(b) 標準
5
<分析>
銀鏡反応(−)かつNaHCO₃と反応しないことから、Yにはアルデヒド基もカルボキシ基もありません。
じゃあ-OH2つか?と思いきや、選択肢にはありませんねー💧
ここで考えるのが、-COOHと-OHの分子内脱水です☝️
今回は選択問題だし、組成式計算でもC₂H₃Oが出るのでまだ易しかった方かと。自分で考える問題だともう少し難度が上がるでしょう。
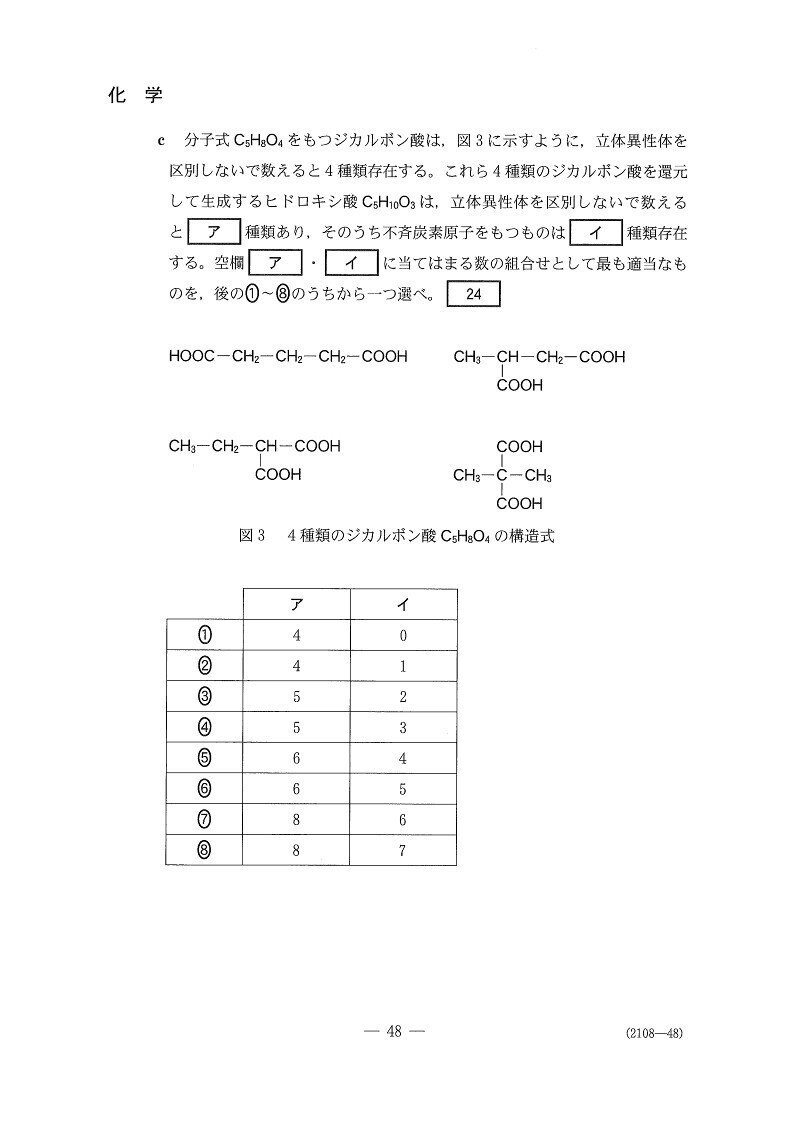
(c) やや易
4
<分析>
実際に書き出して検証するのが最も確実な方法です。このとき、分子の対称性に注意しましょう☝️
第5問



【解答】
(問1) やや易
3
<分析>
3→右端の-CH₃のCは自由に回転できます☝️
2→二重結合1個+環状構造1個で不飽和数が2になることから◯
4→アセチレンの分子式はC₂H₂。高分子化すると、構成単位の三重結合が二重結合に変化します。
(問2)
難関大では頻出のオゾン分解!難関大理系受験生はインプットしといてよい知識だと思います🤔
(a) やや易
4
<分析>
BにCH₃COの構造があるとヨードホルム反応(+)になり不適。逆に、CにはCH₃COの構造があります。よって、答は4。
(b) やや易~標準
3
<分析>
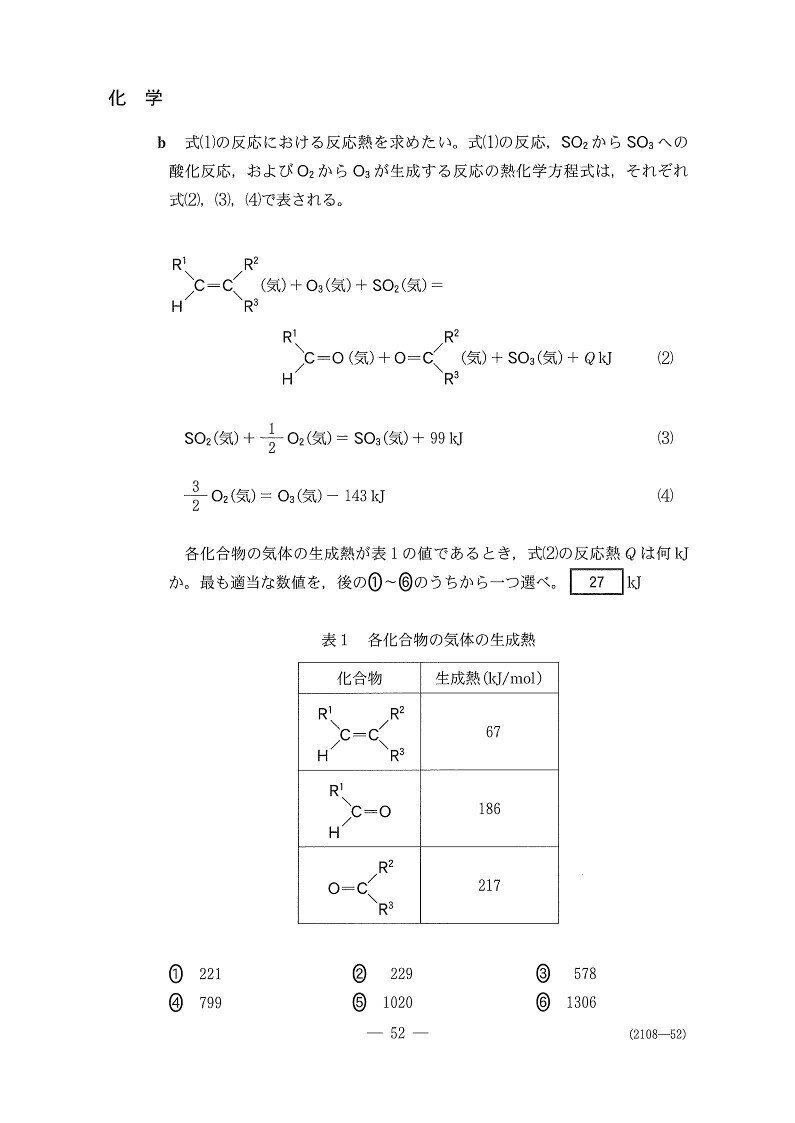
少し手間がかかりますが・・・求めたい熱化学反応式は、A(気)+O₃(気)+SO₂(気)=B(気)+C(気)+SO₃+QkJなので、以下の計算👇により求めることができます。

(c) やや易
3.2×10⁻⁸
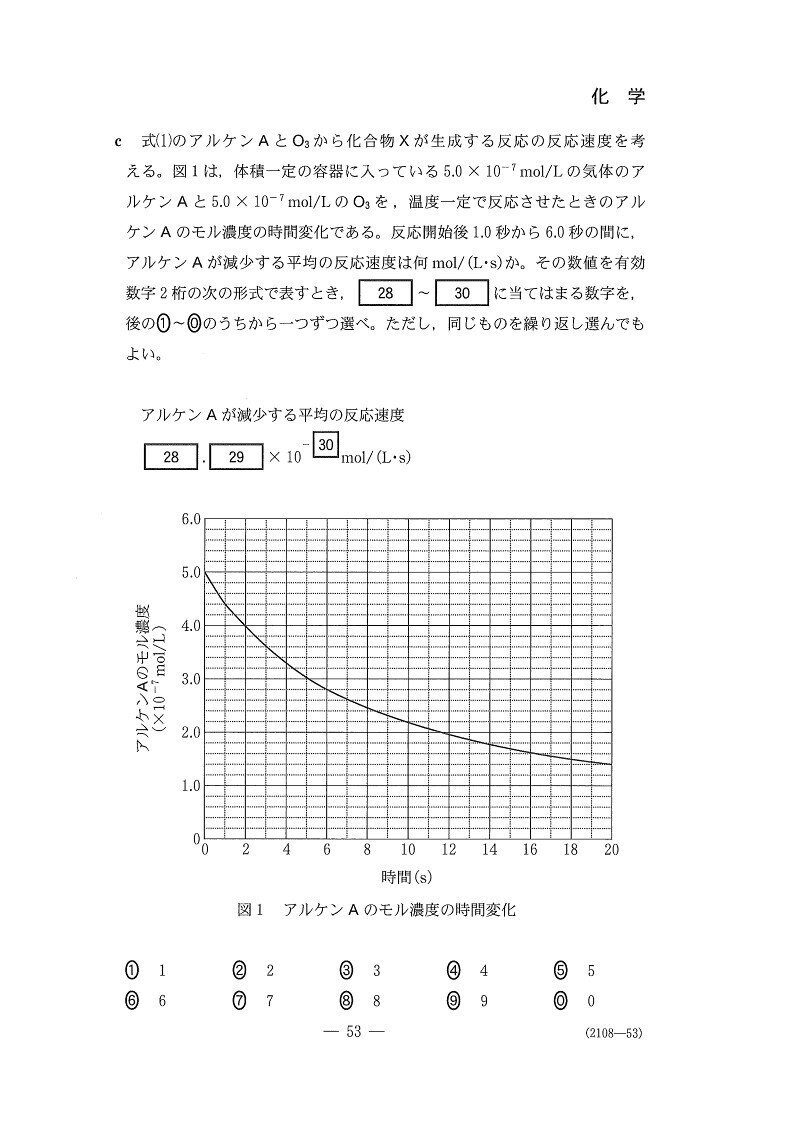
<分析>
1~6秒の間(5秒間)で、Aのモル濃度は(4.4-2.8)×10⁻⁷=1.6×10⁻⁷(mol/L)減少。
∴ 平均の反応速度は1.6×10⁻⁷÷5=3.2×10⁻⁸(mol/L・s)。
(d) 標準
2.5×10⁵
<分析>
(実験1)のデータを基準に考えます。
まず、(実験3)では[O₃]を3倍にするとvも3倍になるので、b=1。
同様に、(実験2)では[A]を4倍,[O₃]を半分にするとvは2倍になるので、a=1が導かれます。
∴ (実験2)の値を使って計算すると
1.0×10⁻⁸=k×4.0×10⁻⁷×1.0×10⁻⁷より、k=2.5×10⁵(L/mol・s)。
総括
今年の数学・理科は難化と聞きましたが、とりあえず化学は一部知識がマイナーなだけ。
京大理系,旧帝大医学部より上を目指すなら、目標は85~90点でしょうか。
最後に、再度公式ラインの紹介をします。
私の公式LINEでは、無料相談を随時受け付けております。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、受験のプロを頼ってみてください✊
【⬇️公式LINE登録はこちら⬇️】






