
受験生の皆さん、こんにちは。
東大合格ビジネスマンのワタシですm(__)m
私のブログでは
① 入試問題の解答・解説
② 受験合格に必要なマインド
③ 3大基礎力重視の裏ワザ勉強法
2022年大学入試、旧帝大の第2弾は「東北大学」です。通称「とんぺー」😂
当ブログの解説記事は、読者の成績を最難関レベルまでグングン伸ばすことを目標にしており、
読者が必死に3年間努力すれば東大(理三以外)・京大(医以外)・九大医レベルに80%以上の確率で合格できることを目的に作成しています。
市販の問題集のように、解法を丁寧に示すだけではありません!多角的なアプローチで問題を解きほぐしています✊
① 各問の難易度
② 他分野や一般常識との関連事項
③ 問題の躓きポイント
④ 極力曖昧な表現をしない説明
を示しています。
イマイチ成績が突き抜けられない受験生に、貴重な情報が提供できればと思いますm(__)m
私の公式LINEでは、無料相談を随時受け付けております。
公立中出身から東大理Ⅲ,京大医学部のA判定に辿り着いた私が、大手予備校や受験秀才が言わない情報を存分に発信します。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、受験のプロを頼ってください✊
私も苦手科目は先生に頼りました。
また、LINE登録していただいた方には
無料プレゼント(1年で偏差値70出す画期的勉強法)
を贈呈します🎁
【⬇️公式LINE登録はこちら⬇️】

東北大化学の特徴
東北大の理科は2科目で150分。そのうち化学は、物理に比べると分量も少なめで導出過程もほぼ必要なく、案外時間が浮きます。
一方の化学は割と軽め。よって、70~75分で一巡したい感じですね🤔
東北大化学は7~8割程度の得点は易しいけど、9割以上はなかなか壁がある・・・
年度によって難易度に大きな変動はなく、絶妙な感じの難易度で安定している印象です。
なので、東北大化学は非常にオススメ!!
旧帝大以上の志望者に対しては、東北大志望でなくても是非解いてほしいと思ってます🤥✊
第1問



【解答】
(問1) 易
(ア) 体積
(イ) ファンデルワールス
<分析>
Z=PV/nRTを扱う実在気体の問題は頻出。正直、大学受験レベルだと、分子自身の体積とファンデルワールス力の影響でほぼ全て説明できます。
「実在気体の状態方程式」なんかも出てくることがあるので、それもよく学習しておきましょう✊
(問2) 易
d
<分析>
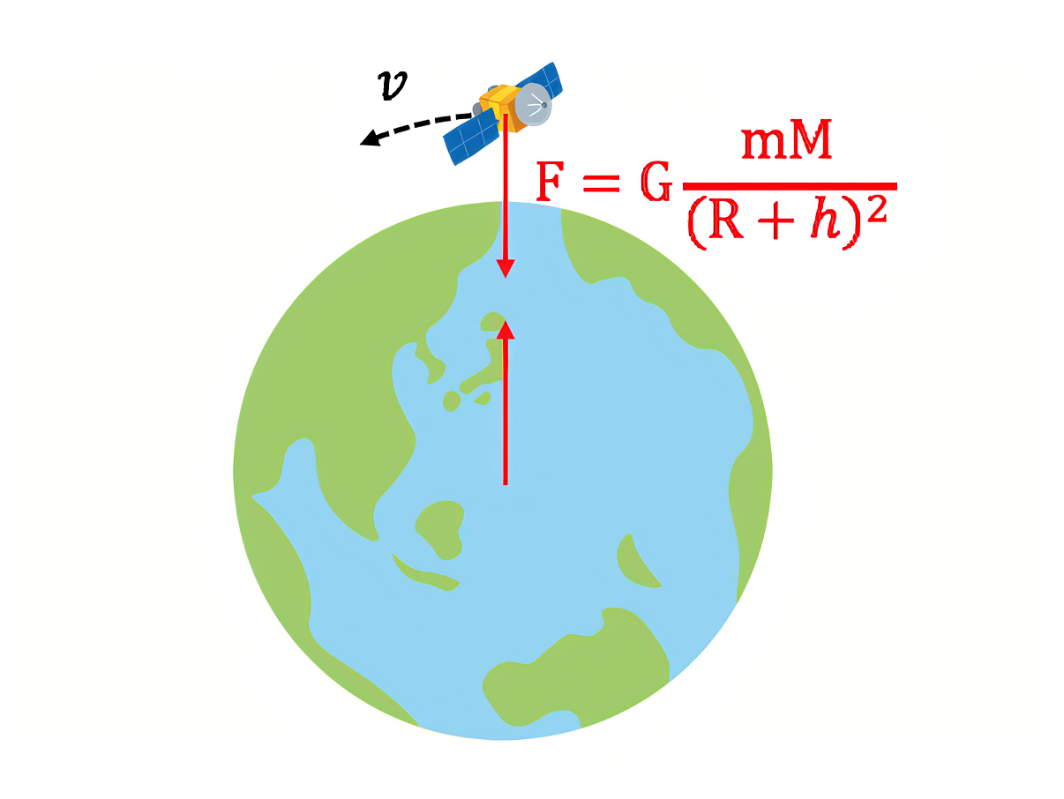
「分子量大→ファンデルワールス力も大」はもはや受験界の常識です。
これは万有引力の公式(質量の積に比例)から考えると明らかでしょう💡
ファンデルワールス力も万有引力と性質は似たもので、天体と人工衛星がが原子×2になっただけ。
(問3) 標準
(a) ◯
(b) ◯
(c) ×
(d) ×
<分析>
(a)
NH₃は分子間で強い水素結合を形成します。よって、強い引き合いが起きて圧力低下に繋がります。すると、Zの値は1より小さくなります。
(b)
前者は後者より圧力大,温度低の条件ですね。てことは、分子の体積の影響もファンデルワールス力の影響も受けやすいということなので、当然Zは1からよりズレます。
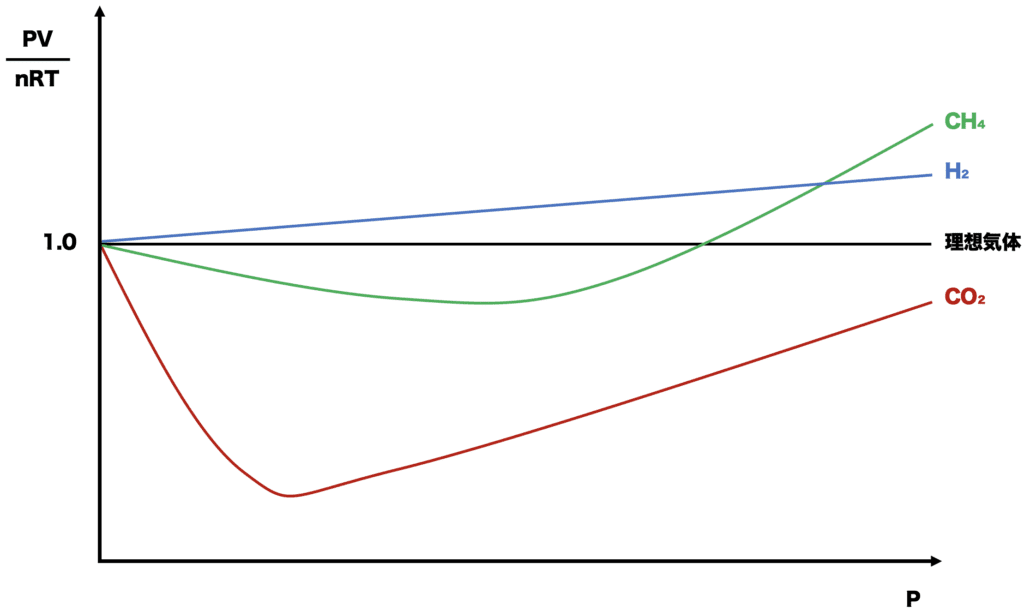
(c),(d)
「H2は常にZ>1」を覚えてないと(d)で間違える可能性あり。CO₂とH₂は実在気体の例で必ず登場する物質なので、是非グラフの概形を覚えておきたいですね☝️
CO2は低圧でZ<1,高圧でZ>1の実在気体らしいグラフを描くのに対して、H2はずっとZ>1のまま。分子量が小さすぎてファンデルワールス力の影響をほぼ受けないからだと言われてます🤔
<実在気体のグラフ>
(問4)
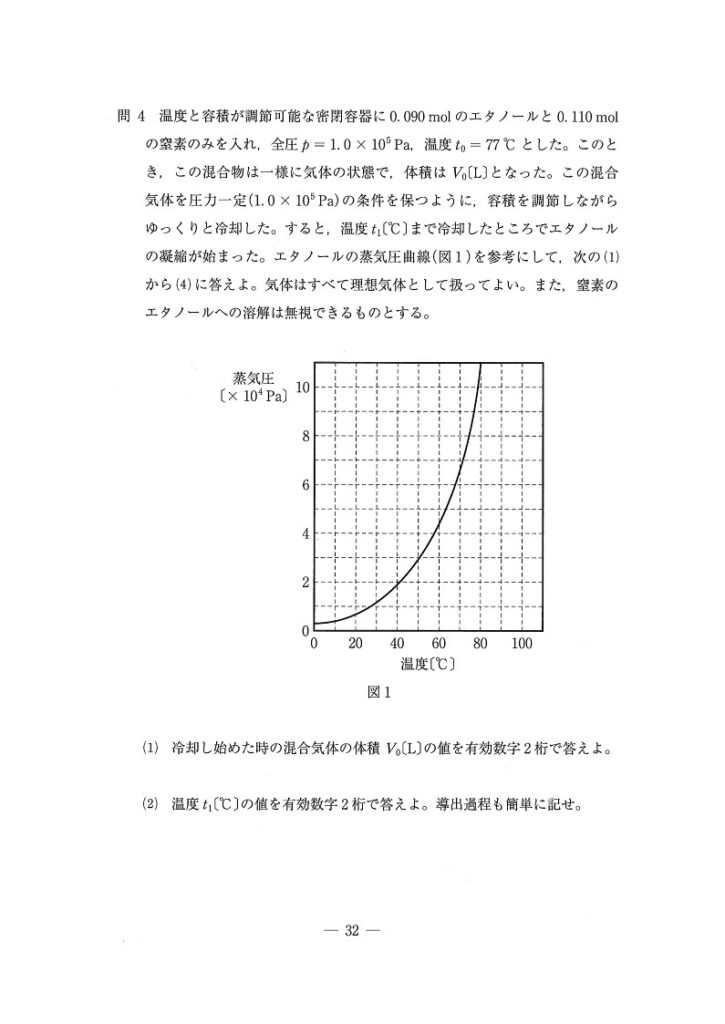
(1) 易
5.8 (L)
<分析>
入れた物質0.20(mol)分はすべて気体なので、状態方程式を使えば即答です!
(2) 易〜やや易
60℃
<分析>
液化が始まるまでは、圧力比において、エタノール:窒素=9:11を維持します。つまり、エタノールの分圧は1.0×10 5 ×9/20 =4.5×10⁴(Pa)のまま。
あとは、飽和蒸気圧曲線が4.5×10 4(Pa)のときの温度を調べれば答が出ます。
(3) やや易
(お) c
(か) d
(き) i
<分析>
全圧一定で低温にすると体積も小さくなります(状態方程式より)。また、体積一定で低温にすると今度は全圧が小さくなります。
液化までに、圧力比において、エタノール:窒素=9:11を維持することを考えると、液化が始まるときのエタノールの分圧は4.5×10⁴(Pa)より小さいのです。よって、t₂もt₁より小さくなります。
(4) 標準
e
<分析>
150(K)=−123(℃)ではN₂は気体です。本問では、ある意味常識を求められてます。「N₂は液化しない」を前提で考えないと間違えますね。
また、点線はPV=nRTを表すので、T=0(K)なら当然P=0です。以上より、答は(e)。
<液体窒素>
沸点は−196℃らしいです💦

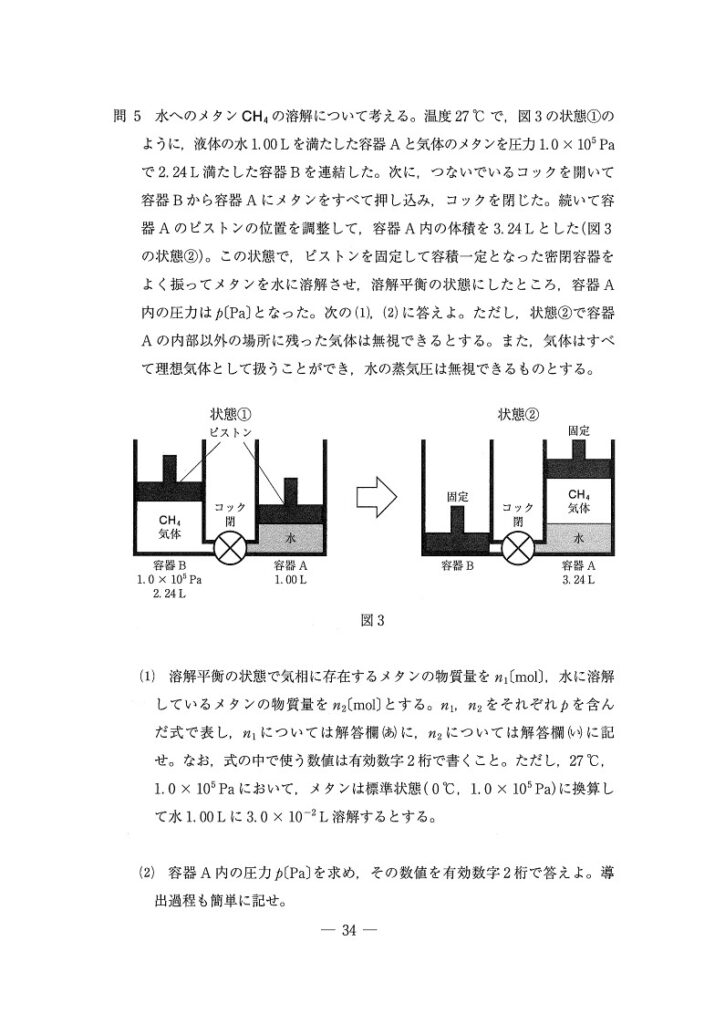
(問5) やや易
(1)
(あ) 9.0×10⁻⁷p(mol)
(い) 1.3×10⁻⁸p(mol)
(2)
9.9×10⁴(Pa)

<分析>
まず状態①で、状態方程式を用いてメタンの物質量を求めます。次に、溶解平衡の状態において、気体のメタン,溶解したメタンの物質量を分圧pを用いて導出します。最後に、n₁+n₂=0.09に代入することで、pが求められます。
これ、ヘンリーの法則の典型的解法ですね💡
<感想>
実在気体,飽和蒸気圧曲線,ヘンリーの法則とどれも有名所からの出題です。
内容もさほど難しくなく、駿台全国の易しめの問題が並んでいる感じでしょうか🤔
第2問
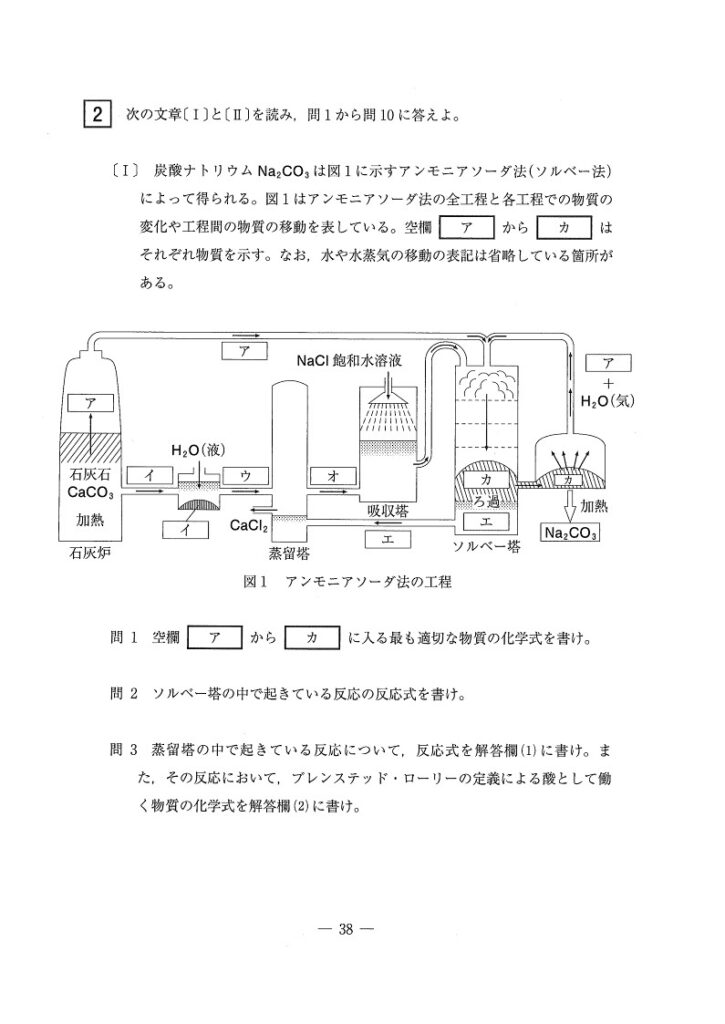



【解答】
(Ⅰ)
(問1) 標準〜やや難
(ア) CO₂
(イ) CaO
(ウ) Ca(OH)₂
(エ) NH₄Cl
(オ) NH₃
(カ) NaHCO₃
<分析>
熱分解に気付けたかが第一歩ですね…炭酸塩を加熱するシーンを見たら「熱分解」を意識。熱分解によりCO2が遊離します。
(ア)がわかれば(イ),(ウ)は余裕ですが、次にエを考えても確定しません。
実は、(エ)が何かを考える前に、ソルベー塔の流入路に着目するのが攻略のコツでした👀
NaCl,H₂O, CO₂が揃えば(カ)が生成しますが、(カ)は加熱でNa₂CO₃になります。それを考えると、(カ)はNaHCO₃と確定します。
しかし、まだ(エ)は確定しません…困っちゃいますね〜。そこで、これが「アンモニアソーダ法」であることに着目すると、(エ)にNH₃あたりが入りそうな気がしますよね。
ただ、 Ca(OH)₂+(エ)で CaCl₂が生成した点を考えると、(エ)はNH₄Cl,(オ)はNH₃となります。
いや〜、ようやく確定しました🥲✊
(問2) 標準〜やや難
NaCl+H₂O+NH₃+CO₂→NaHCO₃+NH₄Cl
<分析>
本問は嫌らしい問題だと思います🤥💦
これね、NaClが関与すると思えなくて詰んだ受験生いたんじゃないかな?
図を見た感じだと、吸収塔のNaClがソルベー塔に入る感じしなくないですか(笑)?
(問3) 標準〜やや難
Ca(OH)₂+2NH₄Cl→ CaCl₂+2NH₃+2H₂O
<分析>
反応式の立式自体は何も難しくありませんが、(1)で(エ),(オ)が決まらないと確信をもった解答ができないのが難点です。
(問4) やや易
(キ) d
(ク) g
<分析>
NH₃が弱塩基性なのは超基本。また、 CO₂+ H₂O⇆ H++ HCO₃⁻の平衡を考えると、塩基性になると(H+少ない)、ルシャトリエの原理より平衡が右に移動します。
NH₃を先に溶かすと、上記の機序でCO₂がより溶けやすくなるとも言えます🤔
(問5) 標準
2.2(g/cm³)

<分析>
これは計算問題というより知識問題です。超頻出なので覚えていた受験生もいたでしょうけど、NaClは面心立方格子です‼️
体心立方格子や六方最密構造と誤ると、自動的に答も誤る嫌らしい問題でした🤥💦
(問6) 標準
b,c,d
<分析>
NaOHは強塩基、Na₂CO₃は弱塩基…この違いは理解できますか?周知の事項だとは思いますが、弱塩基と強酸が反応すると二段階滴定となり滴定結果が違ってきます👀
c,dは回りくどい操作をしているだけで、a,bの逆反応をさせていると考えればOK!
内容的にはやや易レベルなんですが、一問多答形式なのもあり1ランク高い「標準」としました✋
<感想>
アンモニアソーダ法と弱塩基の滴定に関する問題でした。
第1問よりは確実に難易度が高く、ここで差がついたのではないでしょうか??
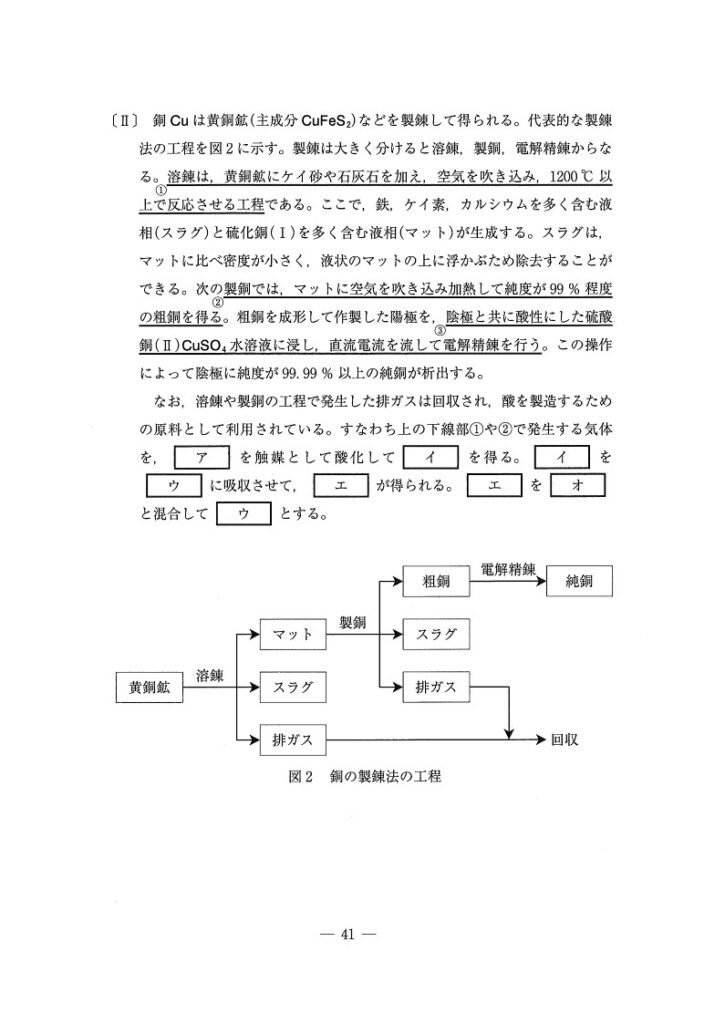
(Ⅱ)
(問7) 標準
2CuFeS₂+4O₂→Cu₂S+2FeO+4SO₂
<分析>
反応物と生成物がわかっているので、Cu,Feについて係数合わせはできます。すると、丁度S3個とO6個が残ります。
なお、SO₂が生じる理由は別にきちんとわからなくてOK。多分Cuの還元と引き換えに酸化されてSO₂になったんでしょうけど🤔
こういうズルも受験では大事です✊
(問8) やや易
Cu₂S+O₂→2Cu+SO₂
<分析>
これも反応物と生成物がわかっているので簡単です。またSO₂が余りました(笑)
「空気とくればO₂, CO₂を想定する」は受験化学の鉄則です✊
(問9) やや難〜難
(ア) V₂O₅
(イ) SO₃
(ウ) 濃硫酸
(エ) 発煙硫酸
(オ) 希硫酸
<分析>
硫酸の生成法は「接触法」でしたね。
そして、SO₂からSO₃を作る過程でしか登場しない有名な触媒はV₂O₅(二酸化五バナジウム)‼️
(ウ)〜(オ)は知識面でむずいです…発煙硫酸を答える問題初めて見た🤥💦
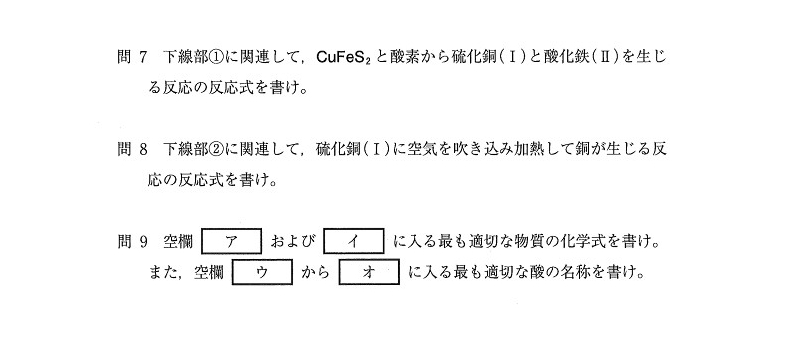
(問10)
[実験]の内容をわかりやすく図示化しましょう👇

(1) 1.5(mol)
(2) 1.5×10⁻²(mol)
(3) 6.5×10⁻¹(mol)



<分析>
陽極ではCu,Feが陽イオンとなって溶け、Agは陽極泥として沈殿します。また、陰極では溶液中にあったCu2+がCuとなって析出します。
まず考えるべくは陰極ですね。何でか?
陽極では3種類の反応が起きて考えにくいのに対し、陰極では Cu²⁺+ 2e⁻→ Cuの反応しか起きないからです💡
(3)は溶けたCuとFeの合計が48.60-1.67=46.93(g)に着目し、溶けた解答Cuをx(g)とおくことで解答のように解くことができます🤔
<感想>
問10の粗銅と純銅の電気分解は超頻出なので、きちんと原理を理解しておきましょう✊
(Ⅱ)は(Ⅰ)に比べるとまだ取り易いけど、問9の後半はキツイですね~。受験生ほぼ全滅だと思うのですが😵💨
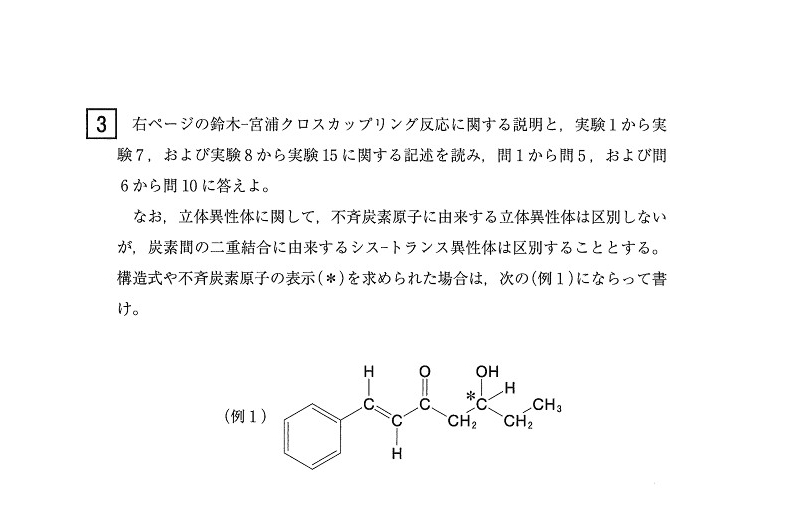
第3問




【解答】
<実験1~7 まとめ>


(問1) 易
C₆H₁₂O
<分析>
超頻出の組成比計算です。<実験2>で示した通りです。
(問2) 易~やや易
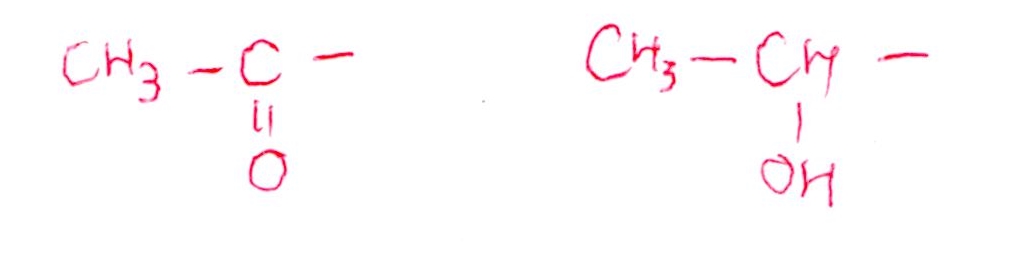
<分析>
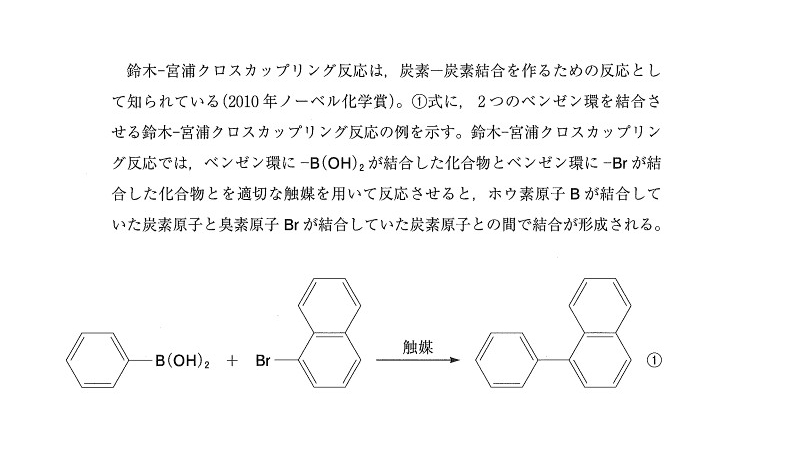
「ヨードホルム反応(+)になる構造覚えてますか?」を聞く問題。
そういや、生成するのはCHI₃でしたね!「だから、CH₃-の構造が必要なんだな~🎵」程度のノリで認識してもらえると忘れにくいと思います✊
(問3) やや易
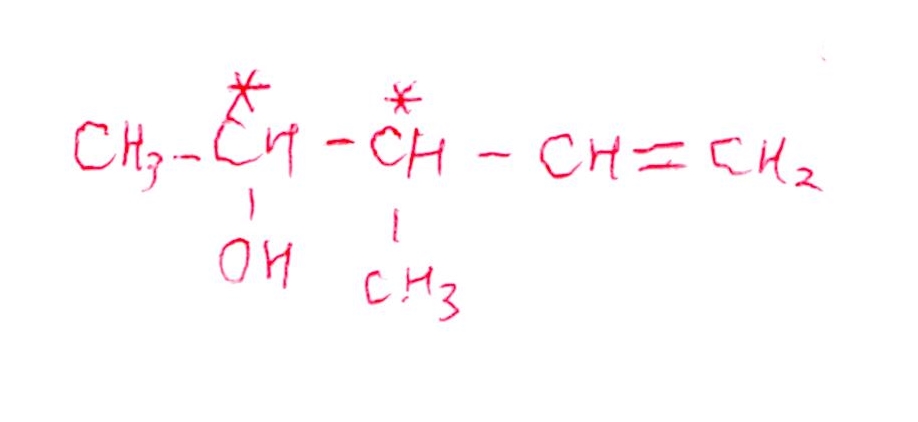
<分析>
(実験4)までで、CにはCH₃-CH(OH)-の構造があることがわかります。
あとは、「残りのCが4個」「不斉炭素2個」「C=Cもある」点を考えると、上記の構造式と特定できます☝
(問4) 標準
<分析>
化合物Cの-OHを隣接するHと脱水させてC=Cを作ればOK。しかし、ここで注意点が・・・問題文の最初に「シス,トランスは区別する」とあります!!
なので、幾何異性体は区別して書く必要がありました。でも、見落とした受験生結構いたのでは?
(問3)ができれば自動的にできるのですが、見落とし難度が地味に高いので、標準としました😂
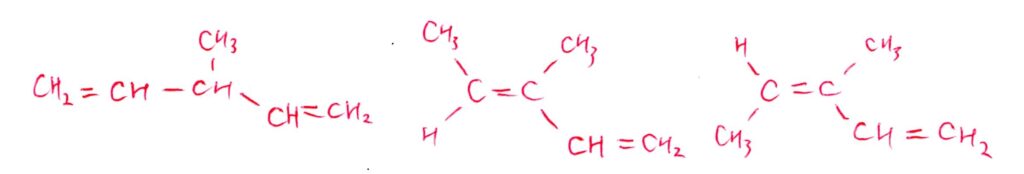
(問5) やや易
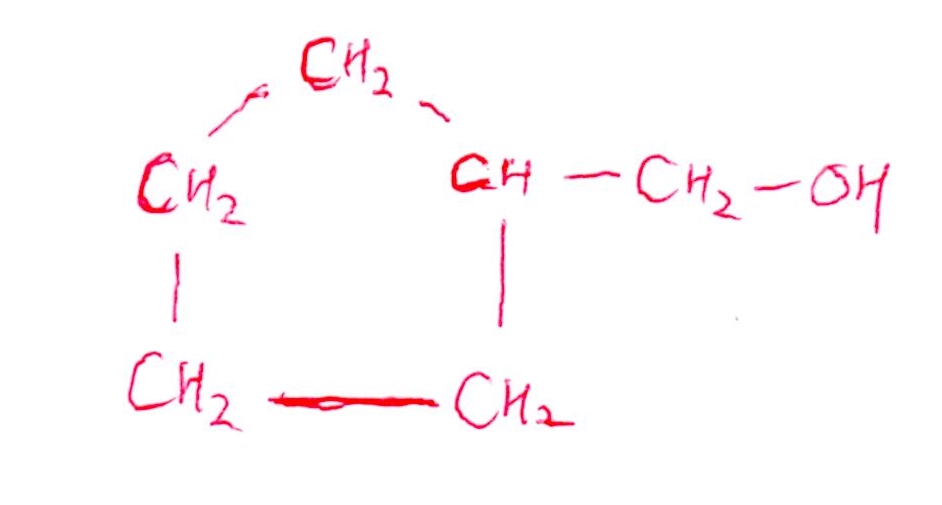
<分析>
-OHが環状構造をなすC原子に結合する場合、必然的に2(3)級アルコールになるため、酸化物のFが銀鏡反応を示す(=アルデヒドになる)ことはありえません✋
よって、-CH₂OHの形が必要になります!
<実験8~15 まとめ>


(問6) やや易
4
<分析>
「トルエン(C₆H₅-CH₃)のどこのHがBrに変化するか」を考えます。
オルト,メタ,パラ位は大丈夫でしょうけど、-CH₃のHがBrに変化するケースを数え忘れないように注意!
(問7) やや易~標準
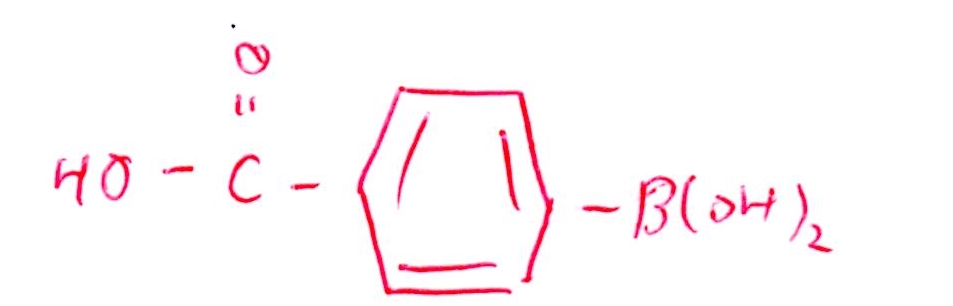
<分析>
(実験10)では-CH₃が-COOHに変化しますが、-COOHが-B(OH)₂からみてオルト,メタ,パラのどこにあるかを確定するには、(実験11)の結果を参照します。
ベンゼン環上のHをClに置換するとき、5種類の化合物が生成するのはパラ位のときのみです。
(問8) やや易~標準
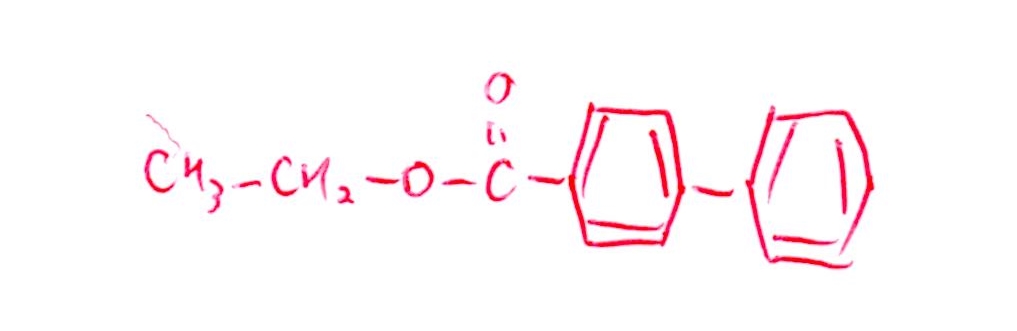
<分析>
カップリング反応させた後でエステル反応させればOKです。
(問9) 標準
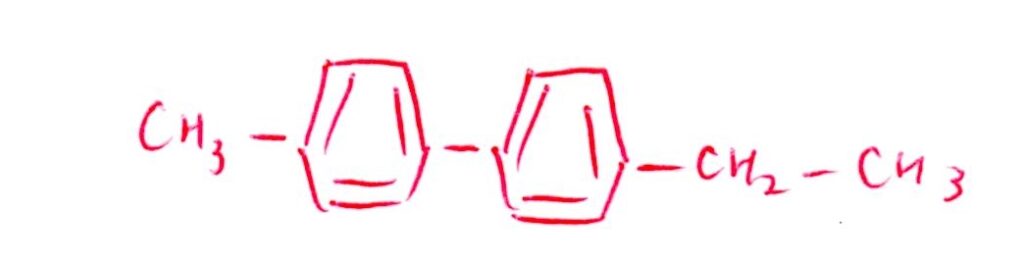
(問10) 標準
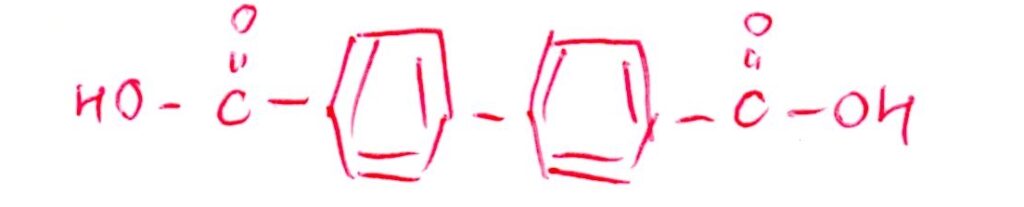
<分析>
化合物BのHをClに置換して化合物が2種類って相当少ないな~と思いますよね👀てか、Bの構造式、思い切り左右対称ですやん!!
異性体の種類が非常に少ないときに意識したいのが「対称性」です。仮にLに-CH₃を2個持っていたとすると、Bの-COOHが3個になる訳ですが、これでは上記の条件を満たすのは不可能です。なので、Lには-CH₂-CH₃が存在すると考えたいです!
<感想>
見掛け倒しな思ったより簡単な問題でした。一昔前の東北大化学は有機だけは骨があったのに、最近のは歯応えがありませんね~🤔💦
鈴木-宮浦クロスカップリング反応とかいう難しそうな反応出てきましたが、全然難しくないですね🤷♂️(実験)も1~15まで用意してさぞかし難易度高いように見せてますが、こちらも芋蔓式に解ける仕様になってますやん🤷♂️
化学が得意な受験生は満点狙いでいい問題、苦手な受験生でも6~7問は取りましょう✊
総括
全体的に8割までは取り易い印象でしたが、完答難易度は2>>>1>3な印象ですね。
1は理論化学の原理をきちんと理解できていれば、3ほどではなくとも完答も狙えます。2はマイナーな知識を要する(問9)とアンモニアソーダ法の読み取り(問1,2)がムズイです💀
合格点は
非医:60~65%
医:80%
程度でしょうか。
最後に、再度公式LINEの紹介をします。
公立中出身から東大理Ⅲ,京大医学部のA判定に辿り着いた私が、大手予備校や受験秀才が言わない情報を存分に発信する公式LINEはこちら👇
登録していただいた方には、無料プレゼント贈呈🎁の他、無料相談も受け付けております。






