
受験生の皆さん、こんにちは。
東大合格ビジネスマンのワタシですm(_ _)m
私のブログでは
① 入試問題の解答・解説
② 受験合格に必要なマインド
③ 3大基礎力重視の裏ワザ勉強法
に関する様々な情報を発信しております📢
私の公式LINEでは、無料相談を随時受け付けております。
公立中出身から東大理Ⅲ,京大医学部のA判定に辿り着いた私が、大手予備校や受験秀才が言わない情報を存分に発信します。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、受験のプロを頼ってください✊
私も苦手科目は先生に頼りました。
また、LINE登録していただいた方には
無料プレゼント(1年で偏差値70出す画期的勉強法)
を贈呈します🎁
【⬇️公式LINE登録はこちら⬇️】

2021年入試、旧帝大の第7弾は
「東京大学」です。
当ブログの解説記事は
読者が必死に3年間努力すれば
東大(理三以外)・京大(医以外)・九大医
レベルに80%以上の確率で合格できる
ことを目的に作成しています
市販の問題集のように、解法を丁寧に示すだけではありません!多角的なアプローチで問題を解きほぐしています✊
① 各問の難易度
② 他分野や一般常識との関連事項
③ 問題の躓きポイント
④ 極力曖昧な表現をしない説明
を示しています。
イマイチ成績が突き抜けられない受験生に貴重な情報が提供できればと思いますm(__)m
東大化学の特徴
東京大学の理科は2科目で制限時間は150分です。問題は標準~やや難程度で、やや思考力が必要な問題が出題されますが
一番の問題は
「時間のなさ」です🤥
理科で高得点(90/120点以上)をガチで狙いにいくとなると、瞬時に設問の意図を理解し、かつ高水準の計算処理力を身に付けることが必要
となります。
著者が受験生の頃とは違い
2017年から
化学の第1問が理論→有機に変化
してますね😲!
第1問はⅠⅡとも有機化学ですが、Ⅰは構造決定能力、Ⅱは有機の知識と理論の考察力を両方聞いてる問題という印象です。
2017年は大幅易化したけど、その後分量・難度ともに再び上昇してきており、油断はできないでしょう。
第1問(Ⅰ)

<最初に>
C₆H₁₂Oは不飽和数=(2×6+2-12)÷2=1より、「C=Cが1個」「C=Oが1個」「環状」のケースが考えられる。
【解答】
(ア) やや易~標準
<分析>
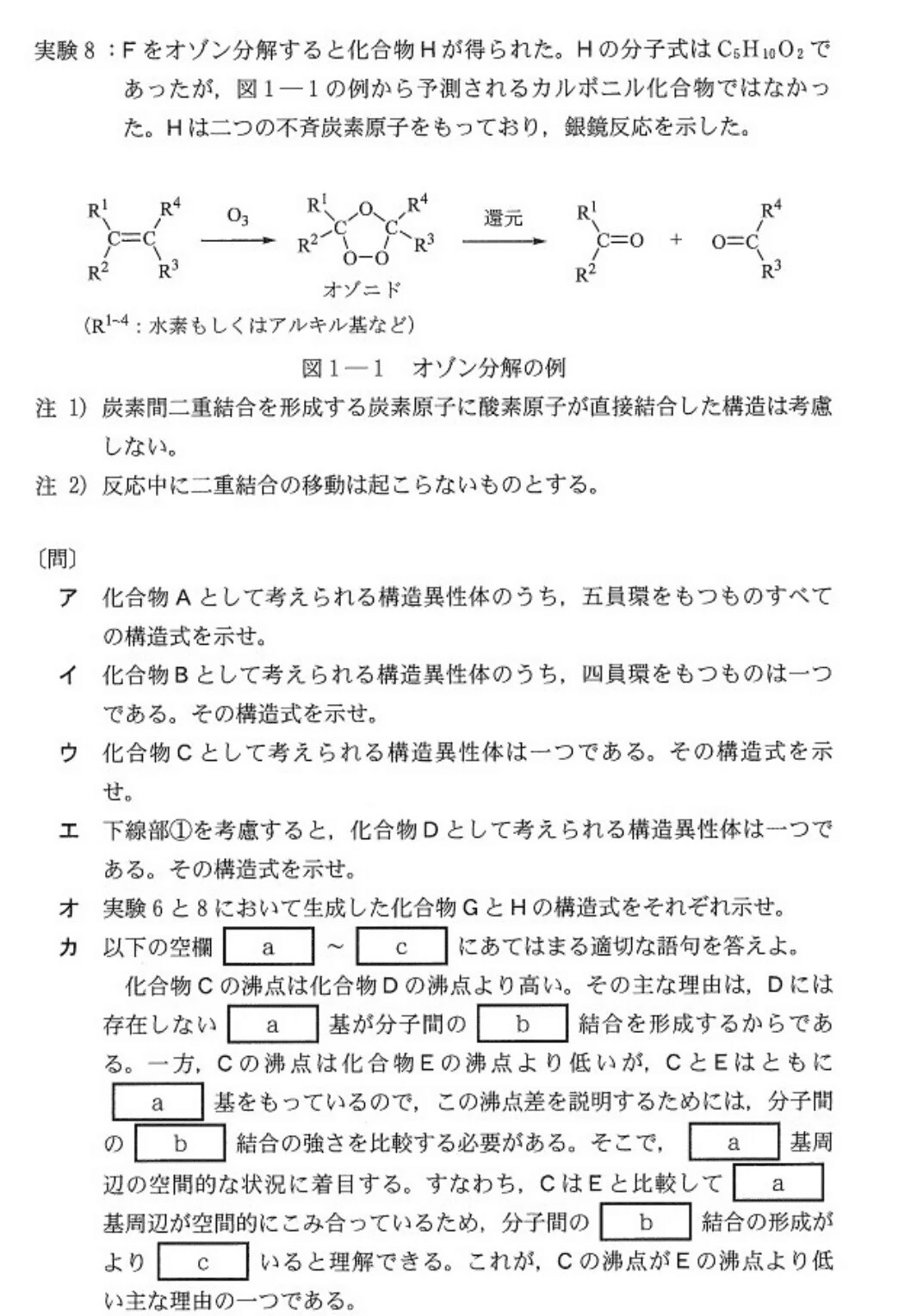
[実験1]より、Naを加えてH₂が発生しないので、Aは環状エーテル!
また、C原子のみで五員環を作るとすると、-O-CH₃の形が必要で、かつ不斉炭素原子が生じないため不適。
五員環ということは、少なくともC4個は環形成に使われる訳です。
よって、「Cが5個使われる場合」と「Cが4個使われる場合」に分けて考えます。候補の構造は少数なので、全部書き出してしまいましょう☝
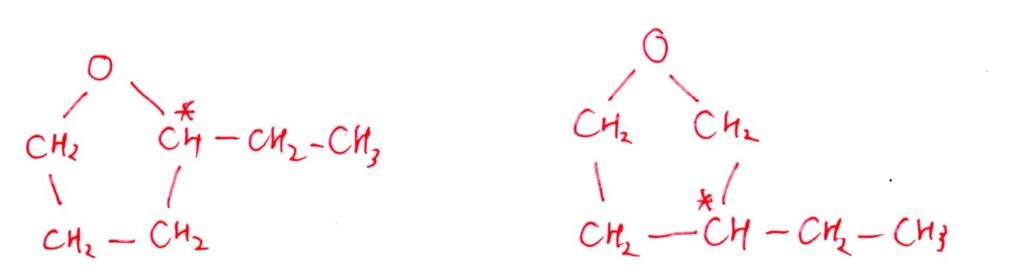
(イ) やや易~標準
<分析>
[実験1,2]より、BはC=Cをもたずに-OHをもつと考えられます。四員環で不斉炭素原子があるものを考えると、答は以下の1つ。これは[実験4]も満たす。
-OHがある時点で四員環を構成する原子はC4個で確定します。また、不斉炭素原子を生じさせるには、側鎖にC2個は必要になるため、構造式は上記の1種類のみです。
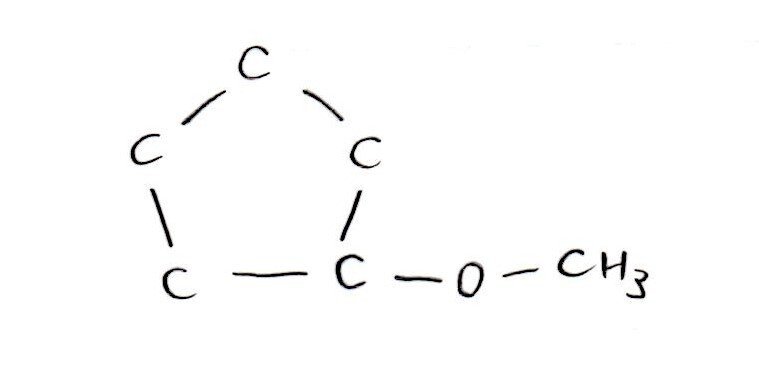
(ウ) 標準
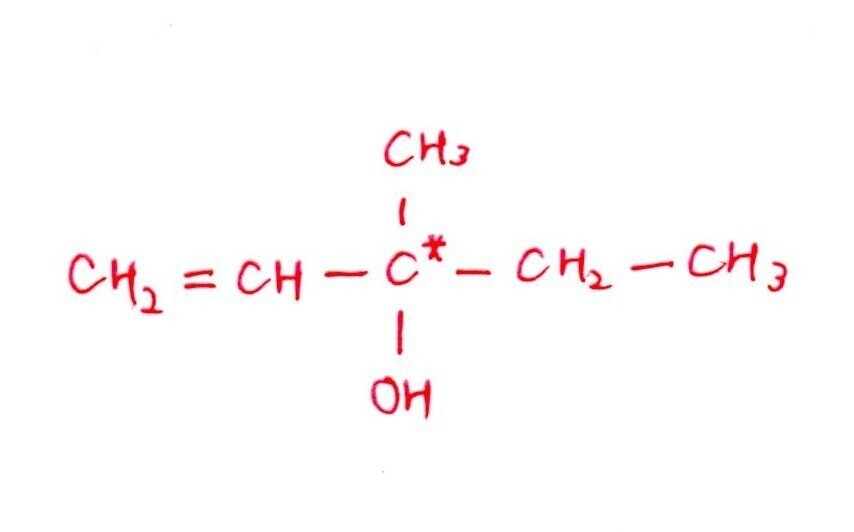
<分析>
[実験1,2]より、CはC=Cをもつ鎖状のアルコール。
+H₂で不斉炭素原子がなくなることから、Cは+H₂を付加すると左右対称の構造。よって、Cの構造式は以下。
「+H₂で不斉炭素原子が消える ⇒ +H₂で左右対称の構造」が着眼点でした。左右対称であることから、一直線上にCは5個、真ん中のCに-CH₃と-OHが付くと考えましょう🤔
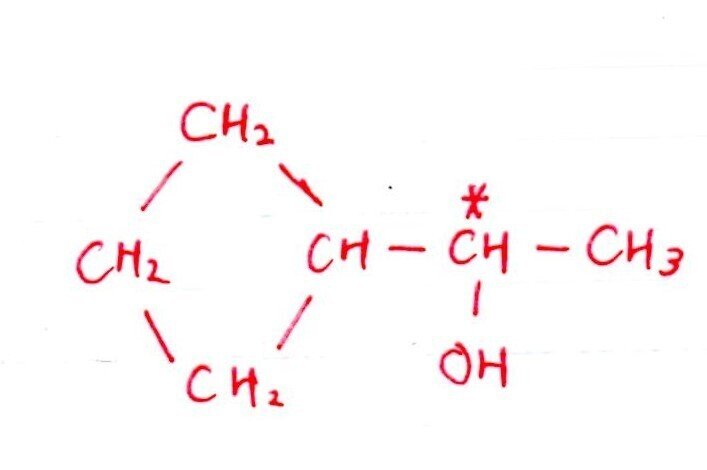
(エ) 標準
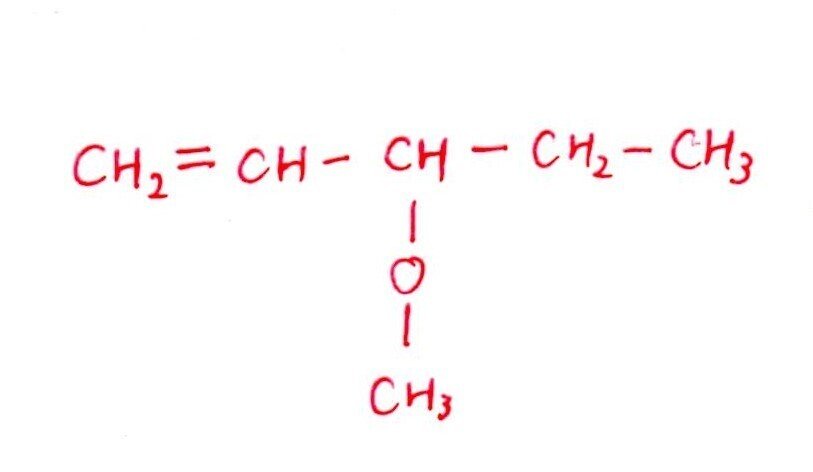
<分析>
[実験1,2]より、DはC=Cをもつ鎖状のエーテルで、①を考慮すると上記の構造に決まります。
(ウ)と同様に、「+H₂で不斉炭素原子が消える ⇒ +H₂で左右対称の構造」が着眼点でした👀
(オ) G → 標準、H→ 難
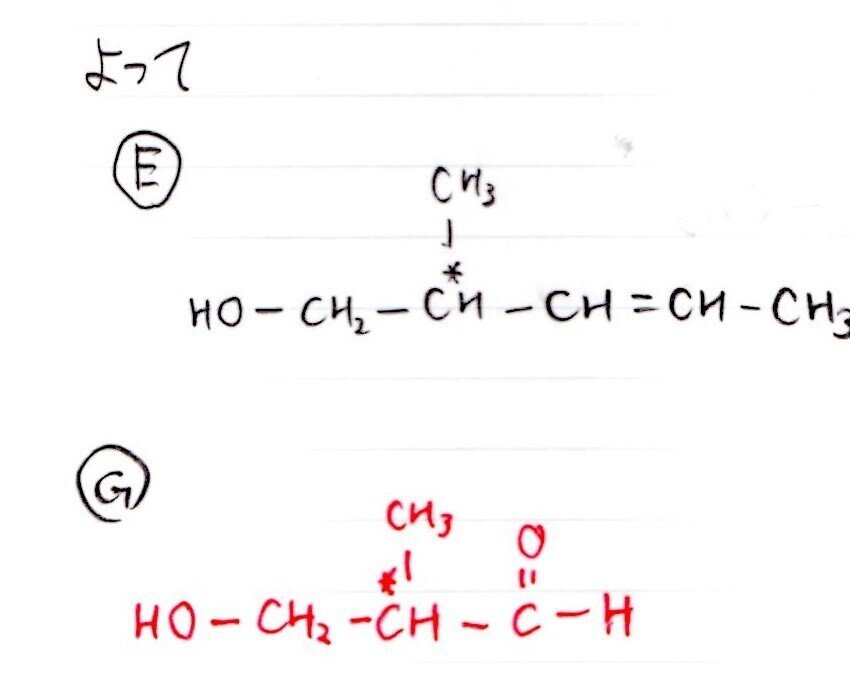
(G)
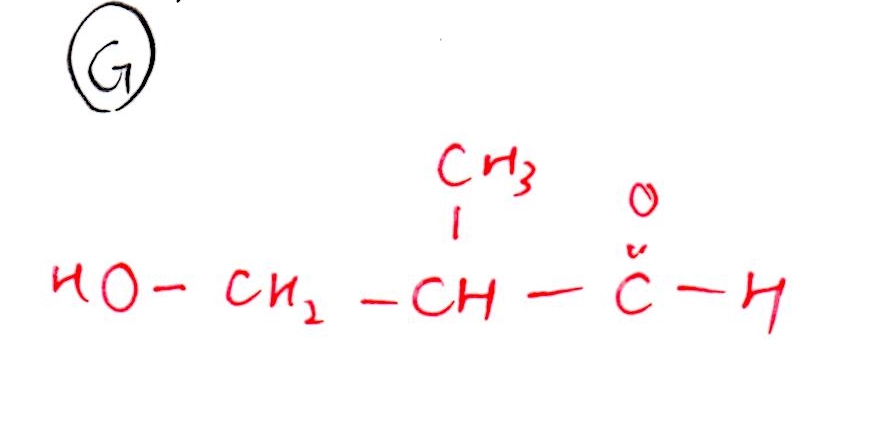
(H)

<解法>
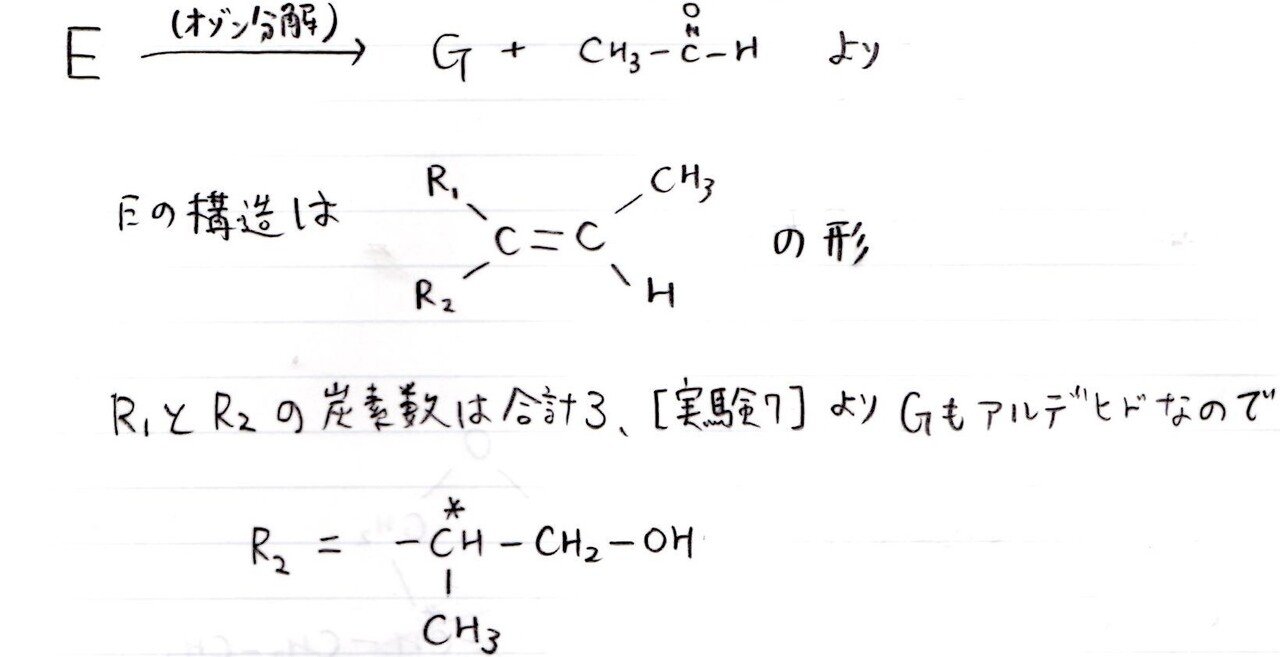

<分析>
Eをオゾン分解産物の1つが判明していること、Gがアルデヒドであることより、Gの構造決定は難しくありません。
Hは難しいです。順当に考えるとアルデヒド基をもつ構造が生成するのですが、そうではないときにどう着想するかが難しかったと思います。
-OHと-CHOの結合は糖類では頻出の「グリコシド結合」です。言われりゃわかるんだけどね~。
(カ) 標準
(a) ヒドロキシ
(b) 水素
(c) 困難になって
<分析>
「Cがアルコール、Dがエーテル」がわかれば容易です。つまり、CとDが決定できれば取れる問題と言えましょう🙄
第1問(Ⅱ)


【解答】
(キ) 易
同位体
<分析>
これはサービス問題。同素体と同位体の区別はさすがに大丈夫ですよね?
(ク) やや易~標準
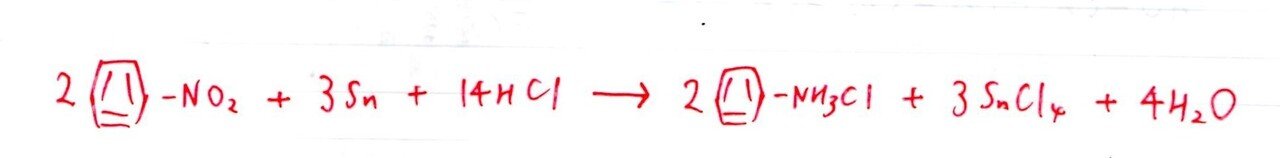
<分析>
ニトロ基(-NO₂)→アミノ基(-NH₂)の有名な反応式です。まともに係数比較しにいくと少し煩雑なんですが、係数も含めて見覚えのある受験生が多かったと思われます🤔
注意すべくは液性ですね。HCl(強酸)の存在下では–NH₂は-NH₃Clに変化するので、そこ注意!!
(ケ) L→やや易~標準、M→やや難
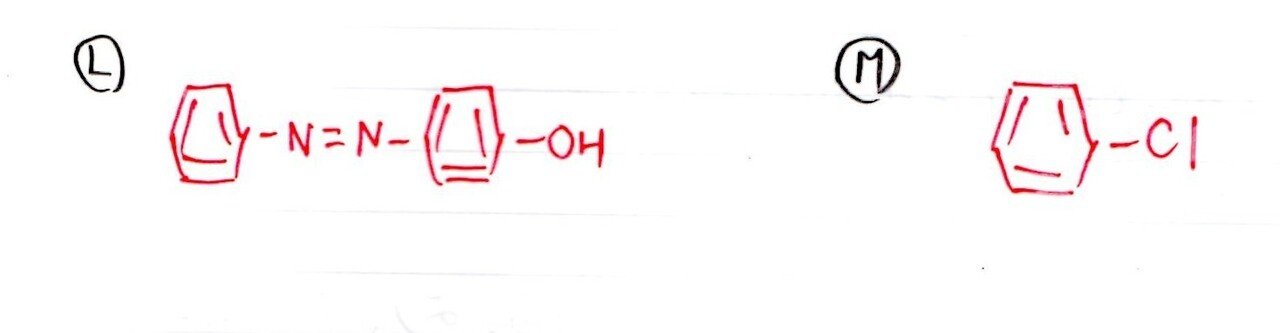
<分析>
銅線で青緑色の炎色反応とくれば・・・ハロゲンの存在を意識しましょう。
ここで登場するのはCl。
「アルカリ融解」の記述に着目して、Mをクロロベンゼンと判断しましょう。少し難しいかな💦
∴Kはフェノールで、Jは塩化ベンゼンジアゾニウムとなり、KとJのジアゾカップリング反応でLが生成します。
(コ) 標準
13:12

<分析>
(サ)で何が起こっているかよくわからなくても、ここでの作業はただの算数ですので、答は出ます!
(サ) 標準
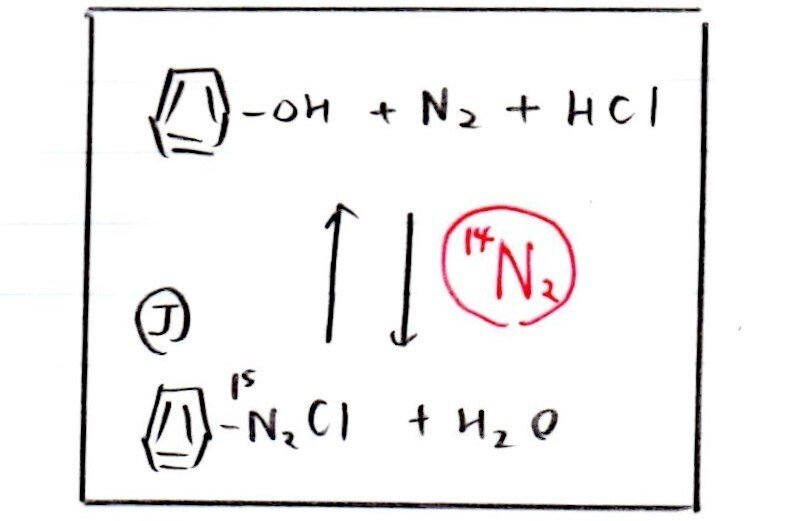
最初、化合物Jにあった¹⁵Nの一部がN₂ガスとなって遊離する。そして、N₂ガス中の¹⁵Nの一部が再び可逆反応によってJとなって戻る。
<分析>
Jが室温で分解するとN₂が発生しますが、ここで充填した¹⁴N₂が平衡反応に関与してきます!つまり、逆反応が起きるときに¹⁴Nを含むJが一部生成するのです☝
<感想>
(Ⅰ)
[実験]だけで判断すると候補が膨大になるので、問題文の指示に着目して絞るとよいでしょう。オのHは言われれば・・という感じですが、自力で答を出すのは難しいです💦
(Ⅱ)
標準的ですが、「銅線の青緑色の炎色反応=ハロゲン」が盲点だった人も多いのでは😵❓
第2問(Ⅰ)

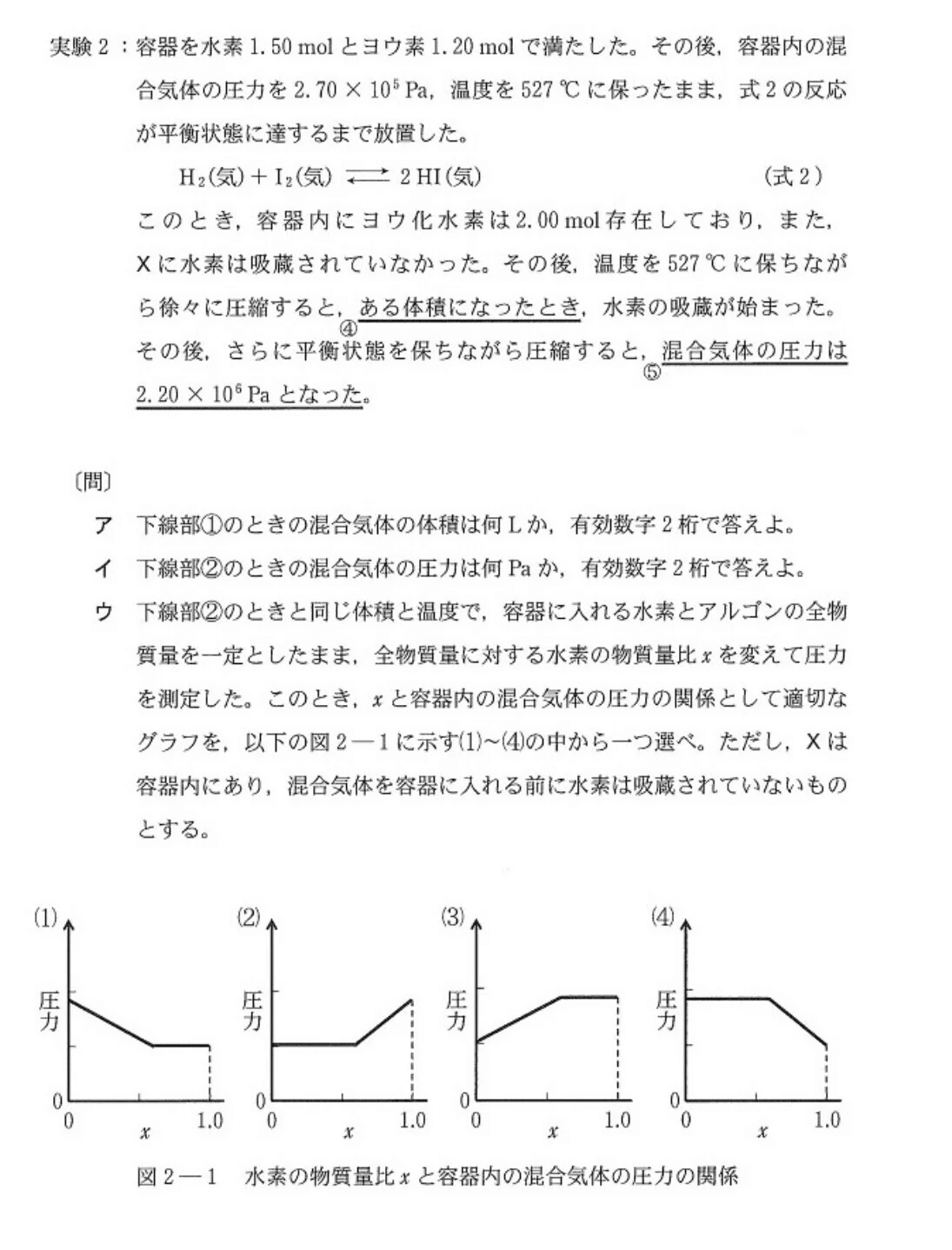

<実験を整理する>
[実験]を図示し、状況を視覚化する👀
・XH₂(固) ⇔ X(固)+H₂(気)
・Kp=2.00×10⁵(Pa)
はじめ、X(固)とH₂(気)が存在するとき、圧力が増して水素分圧が2.00×10⁵(Pa)になるとXH₂(固)が生成し始める。
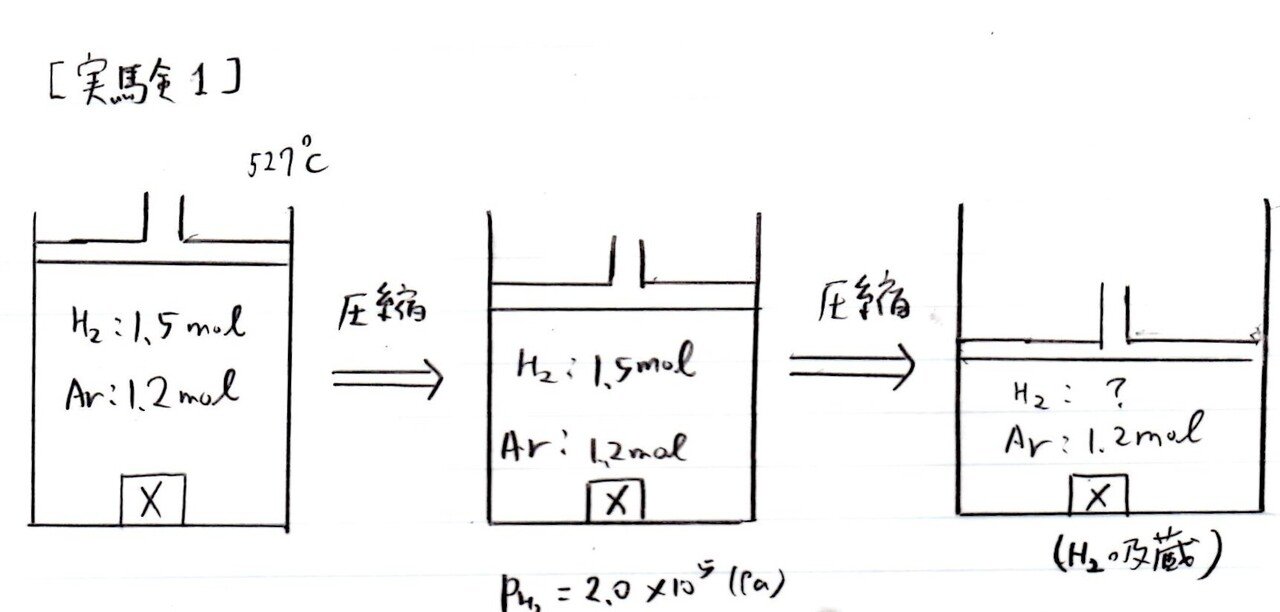
【解答】
(ア) 易
66(L)

(イ) やや易~標準
3.6×10⁵(Pa)
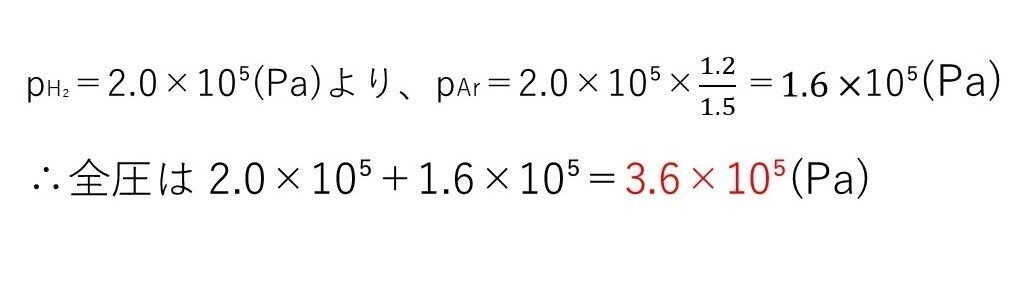
<分析>
水素吸蔵まではH₂とArの物質量比が常に1.5:1.2であることに着目すれば、Arの分圧は求まります。
(ウ) 標準~やや難
4
<分析>
具体的状況で考えてみる。

何となく勘は働くでしょうが、具体的数値で考えてみると選択肢は絞れると思います。
上記ではx≒0のときとx≒1のときを調べていますね🧐
(エ) 標準
1.4 (mol)

<分析>
気体のH₂とXに吸蔵されたH₂がともに存在するとき、水素分圧は2.0×10⁵(Pa)で一定であることに着目しましょう。
すると、「Arの分圧がわかる→気体のH₂とArの物質量比がわかる→吸蔵されたH₂がわかる」の流れで答が出せます。
(オ) やや易
40

(カ) やや難
1.1×10⁶(Pa)

<分析>
本問は「体積変化で平衡が移動しない」に着目できないと解けません。
ノーヒントで気づくのはハードルが高いと思うので、「やや難」でいいでしょう💦
(キ) 標準
1.6×10⁶(Pa)

<分析>
(カ)と無関係にできるのですが、(カ)で挫折した結果、手つかずになった受験生が多かったと思います。
I₂とHIの分圧をx,yを定めれば、条件式2つより、結果的にはx,yについての連立方程式ですね。
第2問(Ⅱ)

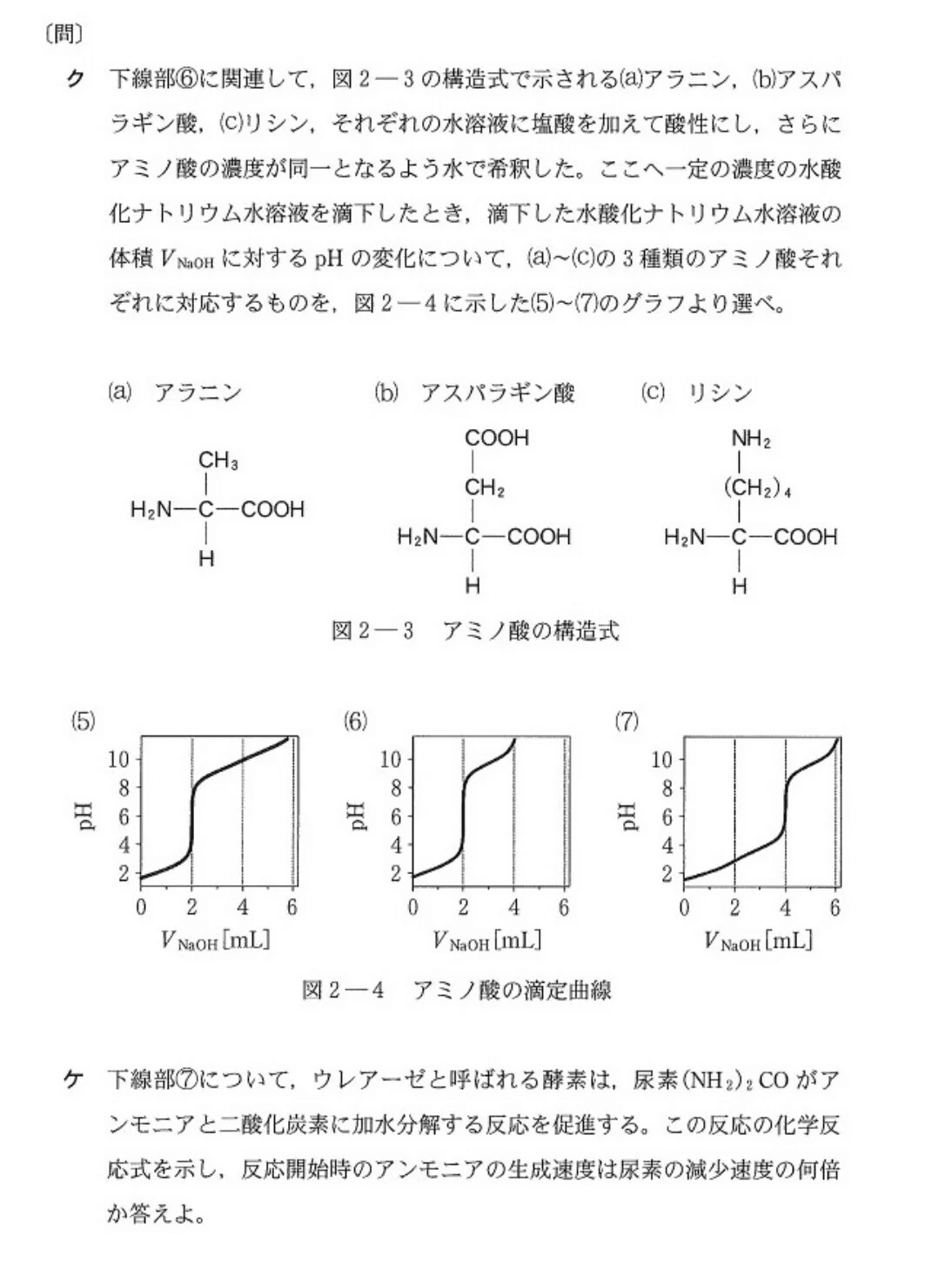

【解答】
(ク)やや易
(a) 6、(b)7、(c) 5
<分析>
NaOHはCOOH→COO⁻、NH₃⁺→NH₂の反応に関与します。
よって、COOHの多いアスパラギン酸がpH=7になるまでにNaOHは多く必要。また、COOH+NH₂の数が3個あるアスパラギン酸とリシンは反応終了までにNaOHが多く必要となります。
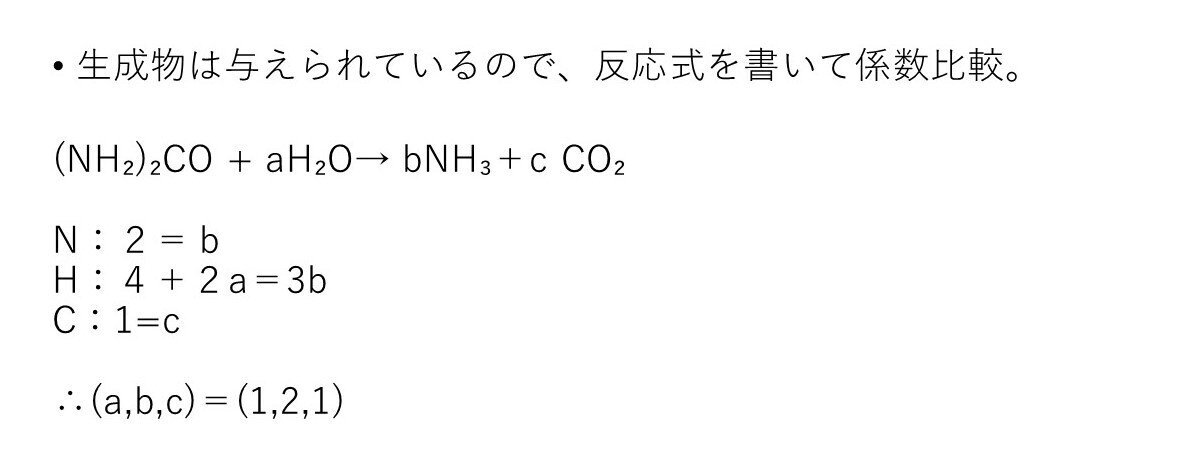
(ケ) 易~やや易
(NH₂)₂CO+H₂O→2NH₃+CO₂
<分析>
尿素の分子式も生成物も与えられているので、ただの係数比較(算数)です(笑)
(コ) 易~やや易
98 (kJ/mol)

<分析>
これも問題文から熱化学方程式を2つ立てて引き算するだけの問題。(ケ)と並んで簡単です!
(サ) やや易
6.5 (kJ/mol)

<分析>
やや計算が重いですが、logの扱いさえわかっていれば、ただの算数に近いです。
(シ) 標準
指数、減少
<分析>
pHが1増すと、水素イオン濃度は1/10倍になることから、1次,2次,対数関数は不適。消去法的に「指数」でいいかな~🤔
と思います。また、[H⁺]が小さいので、濃度に比例して反応速度が「減少」。
<感想>
Ⅰは気体、Ⅱは一部有機を含むが理論分野の寄せ集めといった感じでしょうか。Ⅰは確実に時間を食う分、Ⅱを素早く片付けたいところですね✊
(Ⅰ)
ウの判定にやや手間取るかも。カはH₂+I₂⇔2HIの平衡が体積変化しないことに着目するのが難しかったのでは?しかし、過程を書かせる問題が多すぎるぞ、おい😩💢
(Ⅱ)
ただ指示に従って計算するだけの問題が多く、得点源にしたいです。(サ)はpH=-log₁₀[H⁺]さえ理解していれば勘でも当たります☝
第3問(Ⅰ)


【解答】
(ア) やや易
2Ag⁺+2OH⁻→Ag₂O+H₂O
<分析>
Ag⁺が塩基性下で作る沈殿はAg₂Oです!AgOHではありません✋
東大受験生なら、クリア必須の知識ですね。
(イ) やや易
3,4
<分析>
(1)の対照実験が意味わからん受験生も多かったでしょうけど、誤りを見つけること自体は難しくありません。
(3)は原理を考えると明らかに×、(4)は[Ag(OH)₂]⁻って見たことないよな?と思えれば解決です👋
(2)
AgFが可溶性なのは有名。覚えておきましょう。これは、AgとFの電気陰性度差がかなり大きく、水中で水和(電離)しやすいからです🤔
(3)
電気陰性度差が小さいと共有結合性が増し、電離しにくくなります。(2)の逆ですな!
(4)
AgはOH⁻とは錯イオンを作りません!作るのはNH₃ですね。
(5)
「2CrO₄²⁻+2H⁺ ⇔ Cr₂O₇²⁻+H₂O」の平衡式のことを述べています。
(ウ) 標準
5.3×10⁻⁶(mol/L)

<分析>
問題文より、当量点を正確に読み取りましょう。
「Cl⁻がない条件下でAg⁺を加えていくと16mlの時点でAg₂CrO₄の沈殿ができた」と言いたいようです。
(エ) 標準~やや難
5.4×10⁻⁴(mol/L)

<分析>
(加えたCl⁻の物質量)=(沈殿中のAg⁺の物質量)と考えられますね。
(ウ)で溶液中のAg⁺の物質量がわかるので、加えたAg⁺から引くと、沈殿した分がわかります💡
(オ) 標準
3.9×10⁻⁸(mol/L)

<分析>
(エ)は無関係なようで、(ウ)で[Ag⁺]が求められていればできます!
第3問(Ⅱ)


【解答】
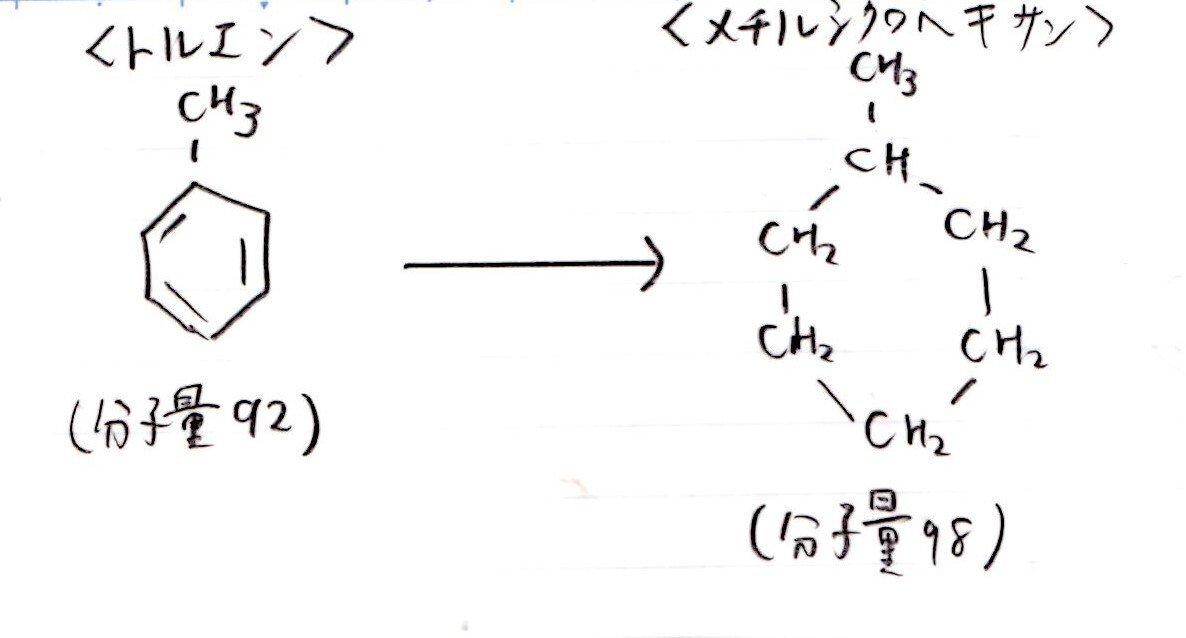
(カ) やや易
21(L)

<分析>
本問は「トルエンの構造式を覚えているか?」を聞く問題のように感じました。
トルエンがわかれば、あとは中学レベルの計算ですから🤥
(キ) 標準
d BB
<分析>
「大小比較→差を取る!」ですね。
隙間に入る原子の最大半径をdAA、dBBとして差を比較すればいいでしょう。

(ク) 標準
A=Ti、B=Fe
<分析>
半径0.03(mm)の水素原子がどちらの隙間なら入るのかを調べればいいですね。
(キ)ができているのが前提です。

(ケ) やや易
3(個)
<分析>
図3-1の単位格子に八面体すき間が何個存在するか調べます(下図)。
すると、側面の数分(=6個)だけあるので、吸収されるH原子は6×1/2 =3個。

(コ) やや難
18(個)、8.7(L)


<分析>
原子数は面倒だけど粘り強く数えましょう!数えられない量じゃないですから✊
あとは、単位格子の体積と、その中にあるH原子の質量を求めれば、示すべき体積も出るでしょう。単位がLなのに注意ですね💨
<感想>
(Ⅰ)
ウ~オは当量点時の溶液が36mlであることさえわかればできますが、対照実験の言い回しがよくわからず、深く考えすぎると沼に嵌る嫌らしさがありますね~🤥
(Ⅱ)
(コ)後半の計算以外は難しくないので、Ⅰよりは短時間で高得点が望めそうです。
総括
第1~3問まで標準~やや難レベル中心。
難問は少ないけど・・・量多すぎ~~😫
特に数値計算の多さと過程を書く問題の多さが原因で、暗算が超得意でも75分では全然足りないよ~!
学力試験というより、もはや競技ですな🏇
第2問(Ⅰ)と第3問(Ⅰ)が難しめなうえに思い切り時間食われそうですね。
そこは程々で撤退して、多少時間かければ高得点を取りやすい他の問題に着手するのがbestな選択であったでしょう。
今回は、難易度以上に時間不足が原因で、合格点は下がるでしょう。
気になる合格点ですが
理Ⅰ,Ⅱ:30点
理Ⅲ:40点
程度かな~。これで十分合格点でしょう。
最後に、再度公式ラインの紹介をします。
私の公式LINEでは、無料相談を随時受け付けております。
成績が低迷しているのに1人で悩むのは時間の無駄ですから、受験のプロを頼ってみてください✊
【⬇️公式LINE登録はこちら⬇️】




